2022-2023學年新疆烏魯木齊七十中高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、單選題(本題包括23小題,每小題2分,共46分。每小題只有一個選項符合題意)
-
1.相同條件下,下列各組熱化學方程式中ΔH1>ΔH2的是( )
A.C(s)+ O2(g)═CO(g)ΔH1;C(s)+O2(g)═CO2(g)ΔH212B.2Al(s)+ O2(g)═Al2O3(s)ΔH1;2Fe(s)+32O2(g)═Fe2O3(s)ΔH232C.2H2S(g)+3O2(g)═2SO2(g)+2H2O(l)ΔH1;2H2S(g)+O2(g)═2S(s)+2H2O(l)ΔH2 D.CaO(s)+H2O(l)═Ca(OH)2(s)ΔH1;NH4HCO3(s)═NH3(g)+CO2(g)+H2O(g)ΔH2 組卷:49引用:3難度:0.8 -
2.下列事實中不能用勒夏特列原理來解釋的是( )
A.紅棕色的NO2氣體,加壓后顏色先變深后變淺 B.由H2、I2(g)、HI(g)氣體組成的平衡體系加壓后顏色變深 C.高壓比常壓有利于合成SO3 的反應 D.黃綠色的氯水光照后顏色變淺 組卷:32引用:3難度:0.6 -
3.將2molX和2molY充入2L密閉容器中進行反應:X(g)+3Y(g)?2Z(g)+aQ(g)。2min末該反應達到平衡時,生成了0.8molZ,測得Q的濃度為0.4mol/L。下列敘述錯誤的是( )
A.a=2 B.0~2min內Y的反應速率為0.3mol/(L?min) C.Y的平衡轉化率為60% D.平衡時X的濃度為1.6mol/L 組卷:13引用:2難度:0.6 -
4.根據下列反應原理設計的應用,不正確的是( )
A.CO32-+H2O?CO3-+OH-用熱的純堿溶液清洗油污效果更佳 B.Al3++3H2O?Al(OH)3(膠體)+3H+明礬凈水 C.Cl2+H2O?HCl+HClO新制氯水中加入碳酸鈣,提高次氯酸濃度 D.Fe3++3H2O?Fe(OH)3+3H+配制Fe2(SO4)3溶液時,加入一定量Fe粉 組卷:17引用:1難度:0.7 -
5.常溫下,0.005mol?L-1的H2SO4溶液中由水電離出的OH-的物質的量濃度為( )
A.0.01mol?L-1 B.1.0×10-12mol?L-1 C.2.0×10-12mol?L-1 D.無法確定 組卷:14引用:4難度:0.7 -
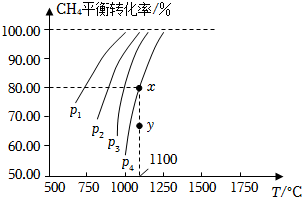 6.在一恒容的密閉容器中充入0.1mol/LCO2、0.1mol/LCH4,在一定條件下發生反應CH4(g)+CO2(g)?2CO(g)+2H2(g),測得CH4平衡時轉化率與溫度、壓強的關系如圖,下列有關說法不正確的是( )
6.在一恒容的密閉容器中充入0.1mol/LCO2、0.1mol/LCH4,在一定條件下發生反應CH4(g)+CO2(g)?2CO(g)+2H2(g),測得CH4平衡時轉化率與溫度、壓強的關系如圖,下列有關說法不正確的是( )A.上述反應的ΔH>0 B.壓強:p4>p3>p2>p1 C.1100℃時該反應平衡常數約為1.64 D.壓強為p4時,在y點:v(正)<v(逆) 組卷:21引用:1難度:0.7 -
7.在一定體積的密閉容器中,某化學反應的平衡常數表達式為K=
,在不同的溫度下該反應的平衡常數值分別為:c(CO2)c(H2)c(CO)c(H2O)
下列有關敘述不正確的是( )t℃ 700 800 830 1000 1200 K 1.67 1.11 1.00 0.60 0.38 A.該反應的化學方程式是:CO(g)+H2O(g)?CO2(g)+H2(g) B.上述反應的正反應是放熱反應 C.830℃時加入CO2和H2各1mol,測得CO為0.4mol時,v正>v逆 D.若平衡濃度符合下列關系式: ,此時的溫度是1000℃c(CO2)3c(CO)=c(H2O)5c(H2)組卷:35引用:1難度:0.7 -
8.在Na2S溶液中存在著多種分子和離子,下列關系不正確的是( )
A.c(OH-)=c(HS-)+c(H+)+c(H2S) B.c(OH-)=c(HS-)+c(H+)+2c(H2S) C.c(Na+)=2[c(HS-)+c(S2-)+c(H2S)] D.c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) 組卷:63引用:2難度:0.5 -
9.下列實驗操作會使實驗最終結果偏高的是( )
A.用濕潤的pH試紙測定NaOH的pH B.用0.0001mol?L-1鹽酸滴定20.00mLNaOH溶液時,未排盡滴定管尖嘴處的氣泡 C.用0.0001mol?L-1鹽酸滴定20.00mLNaOH溶液時,滴定前讀數時仰視,滴定后平視 D.測定中和熱的數值時,將0.5mol?L-1NaOH溶液倒入鹽酸后,立即讀數 組卷:5引用:1難度:0.7
二、非選擇題(本題包括五道小題,共54分)
-
27.自然界是各類物質相互依存、各種變化相互制約的復雜平衡體系,水溶液中的離子平衡是其中一個重要方面。請根據所學知識,回答下列問題。
(1)常溫下將pH均為3,體積均為V0的HA和HB溶液,分別加水稀釋至體積V,pH隨lg的變化如圖所示。VV0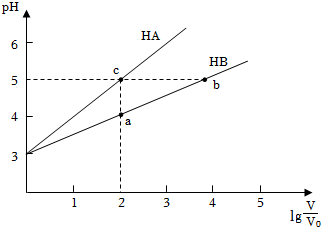
①a、b、c三點水的電離程度(用“>”、“=”、“<”填空)。
②常溫下,取上述pH均為3的HA和HB溶液各100mL,向其中分別加入足量的Zn粒,反應結束時HA中產生氫氣的物質的量為n1,HB溶液中產生氫氣的物質的量為n2,則n1n2(用“>”、“=”、“<”填空)。
(2)查閱資料獲得25℃時部分弱電解質的電離平衡常數數據:
①KSCN溶液呈弱堿性,用離子方程式解釋原因化學式 HF HClO H2CO3 CH3COOH HSCN NH3?H2O 電離平衡常數 6.3×10-4 4.0×10-8 K1=4.5×10-7
K2=4.7×10-111.75×10-5 0.13 Kb=1.8×10-5 。
②Na2CO3溶液的水解平衡常數Kh1=(保留兩位有效數字)。
③同濃度的NaF溶液和CH3COOK溶液相比,后者溶液中c(K+)-c(CH3COO-)前者溶液中c(Na+)-c(F-)(用“>”、“=”、“<”填空)。
④現有25℃時等濃度的5種溶液:A.NH4ClB.CH3COONH4C.NH4SCND.NH4HCO3E.NH4HSO4。這5種溶液中NH4+濃度由大到小的順序排列是:(填字母)。組卷:8引用:1難度:0.6 -
28.習近平總書記在世界領導人氣候峰會上指出,中國將在2030年前實現“碳達峰”、2060年前實現“碳中和”。這是中國基于推動構建人類命運共同體的責任擔當和實現可持續發展的內在要求作出的重大戰略決策。因此CO2的捕集、創新利用與封存成為科學家研究的重要課題。
Ⅰ.最近有科學家提出“綠色自由”構想:先把空氣吹入飽和碳酸鉀溶液,然后再把..從溶液中提取出來,并使之變為可再生燃料甲醇。“綠色自由”構想技術流程如圖: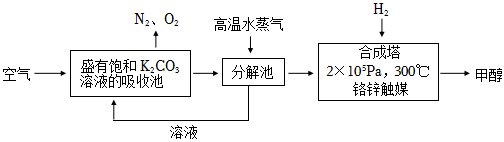
(1)在合成塔中,CO2與H2反應,生成氣態的H2O和CH3OH。
已知:i.CO2(g)+H2(g)?CO(g)+H2O(g)ΔH1=+41.19kJ/mol
ii.CO(g)+2H2(g)?CH3OH(g)ΔH2=-99.77kJ/mol
①寫出合成塔中反應的熱化學方程式。
②若反應i為慢反應,下列示意圖中能體現上述反應能量變化的是。
A.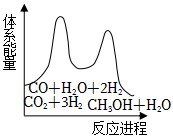 B.
B.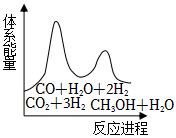
C.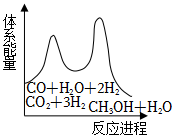 D.
D.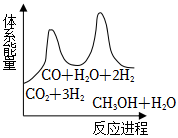
(2)在一定條件下,在某催化劑作用下,向2L恒容密閉容器中充入2molCO2和3molH2發生以上制備甲醇的反應,測得在相同時間內,不同溫度下H2的轉化率如圖所示,已知T2時已達平衡狀態。
①a點v正v逆(填“>”,“<”,“=”);
②b點的轉化率比c點高的原因是;
③T2時,若平衡時壓強為1.7MPa,Kp=MPa-2(計算結果保留三位有效數字,Kp為以分壓表示的平衡常數,分壓=總壓×物質的量分數)。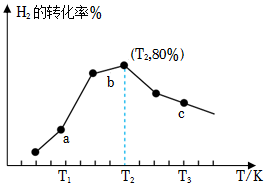
Ⅱ.在一定條件下,和可以直接化合生成甲酸(HCOOH)。
(3)溫度為t1℃時,將等物質的量的CO2和H2充入體積為1L的密閉容器中發生反應:CO2(g)+H2(g)?HCOOH(g)ΔH=-31.4kJ/mol,K=2。實驗測得:v正=k正c(CO2)c(H2)、v逆=k逆c(HCOOH),k正、k逆為速率常數。t1℃時,=k正k逆;溫度為t2℃時,k正=2.2k逆,則t2℃(填“>”“<”或“=”)t1℃。組卷:13引用:2難度:0.5


