2012-2013學(xué)年山東省濟(jì)寧市兗州實(shí)驗(yàn)中學(xué)高二(上)模塊檢測(cè)化學(xué)試卷(有機(jī)化學(xué)基礎(chǔ))
發(fā)布:2024/12/13 8:0:14
一、選擇題(本題包括18小題,每小題3分,共54分.每小題有一個(gè)選項(xiàng)符合題意.)
-
1.空氣是人類生存所必需的重要資源,為改善空氣質(zhì)量而啟動(dòng)的“藍(lán)天工程”得到了全民支持.下列措施不利于“藍(lán)天工程”建設(shè)的是( )
A.推廣使用燃煤脫硫技術(shù),防治SO2污染 B.實(shí)施綠化工程,防治揚(yáng)塵污染 C.研制開發(fā)燃料電池汽車,消除機(jī)動(dòng)車尾氣污染 D.加大石油,煤炭的開采速度,增加化石原料供應(yīng)量 組卷:186引用:74難度:0.9 -
2.下列說法正確的是( )
A.需要加熱才能發(fā)生的反應(yīng)一定是吸熱反應(yīng) B.反應(yīng)物和生成物各自具有的總能量決定反應(yīng)是放熱還是吸熱 C.任何放熱反應(yīng)在常溫條件下一定能發(fā)生 D.鎂和氧氣反應(yīng)生成氧化鎂后,生成物能量明顯升高 組卷:14引用:1難度:0.9 -
3.含Ba(OH)2 17.1g的稀溶液與足量稀鹽酸反應(yīng),放出11.46KJ熱,表示該反應(yīng)中和熱的化學(xué)方程式正確的是( )
A.Ba(OH)2(aq)+2HCl(aq)=BaCl2(aq)+2H2O(l)△H=-114.6KJ/mol B.Ba(OH)2(aq)+2HCl(aq)=BaCl2(aq)+2H2O(l)△H=+114.6KJ/mol C. Ba(OH)2(aq)+HCl(aq)=12BaCl2(aq)+H2O(g)△H=-57.3KJ/mol12D. Ba(OH)2(aq)+HCl(aq)=12BaCl2(aq)+H2O(l)△H=+57.3KJ/mol12組卷:51引用:6難度:0.9 -
4.下列說法或表示方法正確的是( )
A.等質(zhì)量的硫蒸氣和硫固體分別完全燃燒,后者放出的熱量多 B.由C(石墨)→C(金剛石);△H=+1.9 kJ/mol可知,金剛石比石墨穩(wěn)定 C.在稀溶液中:H+(aq)+OH-(aq)═H2O(l);△H=-57.3 kJ/mol,若將含0.5mol H2SO4的濃硫酸與含1mol NaOH的稀溶液混合,放出的熱量大于57.3 kJ D.在101kPa、25℃時(shí),2g H2完全燃燒生成液態(tài)水,放出285.8 kJ熱量,氫氣燃燒的熱化學(xué)方程式表示為:2H2(g)+O2(g)═2H2O(l);△H=-285.8 kJ/mol 組卷:48引用:21難度:0.7 -
5.(1)已知膽礬失水的化學(xué)反應(yīng)方程式為:CuSO4?5H2O(s)=CuSO4(s)+5H2O(l);△H=+Q1kJ/mol
(2)室溫下,無水硫酸銅溶于水的熱化學(xué)方程式為:
CuSO4(s)=Cu2+(aq)+SO42-(aq);△H=-Q2kJ/mol
(3)膽礬溶于水時(shí),溶液溫度降低.Q1與Q2的關(guān)系是(Q1、Q2為正數(shù))( )A.Q1>Q2 B.Q1=Q2 C.Q1<Q2 D.無法確定 組卷:44引用:6難度:0.7 -
6.甲醇質(zhì)子交換膜燃料電池中將甲醇蒸氣轉(zhuǎn)化為氫氣的兩種反應(yīng)原理是:
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)ΔH=+49.0kJ?mol-1
②CH3OH(g)+O2(g)═CO2(g)+2H2(g)ΔH=-192.9kJ?mol-112
下列說法正確的是( )A.CH3OH的燃燒熱為192.9kJ?mol-1 B. 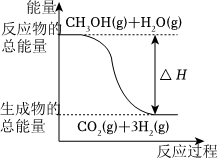
反應(yīng)①中的能量變化如圖所示C.CH3OH轉(zhuǎn)變成H2的過程一定要吸收能量 D.根據(jù)②推知反應(yīng)CH3OH(l)+ O2(g)═CO2(g)+2H2(g)的ΔH>-192.9kJ?mol-112組卷:581引用:126難度:0.7 -
7.在一定溫度下體積固定的容器中,可以充分說明可逆反應(yīng)A(g)+3B(g)?3C(g)+D(g),達(dá)到平衡狀態(tài)的是( )
A.器內(nèi)壓強(qiáng)不隨時(shí)間變化而變化 B.反應(yīng)器內(nèi)A、B、C、D物質(zhì)的量比為1:3:3:1 C.生成A的速率和生成的D的速率相等 D.生成 1mol A同時(shí)有3 mol C被消耗 組卷:69引用:9難度:0.9
二、非選擇題,共46分
-
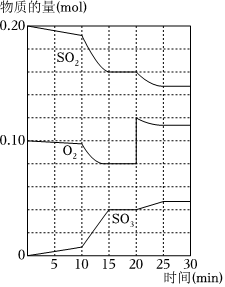 22.在一定條件下,二氧化硫和氧氣發(fā)生如下反應(yīng):2SO2(g)+O2 (g)?2SO3(g) (△H<0)
22.在一定條件下,二氧化硫和氧氣發(fā)生如下反應(yīng):2SO2(g)+O2 (g)?2SO3(g) (△H<0)
(1)寫出該反應(yīng)的化學(xué)平衡常數(shù)表達(dá)式 K=
(2)降低溫度,該反應(yīng)K值,二氧化硫轉(zhuǎn)化率,化學(xué)反應(yīng)速度(以上均填增大、減小或不變)
(3)600℃時(shí),在一密閉容器中,將二氧化硫和氧氣混合,反應(yīng)過程中SO2、O2、SO3物質(zhì)的量變化如圖,反應(yīng)處于第一次平衡狀態(tài)的時(shí)間是.
(4)據(jù)圖判斷,反應(yīng)進(jìn)行至20min時(shí),曲線發(fā)生變化的原因是(用文字表達(dá)),10-15min的曲線變化的原因能是(填寫編號(hào))
a.加了催化劑 b.縮小容器體積 c.降低溫度 d.增加SO3的物質(zhì)的量.組卷:323引用:29難度:0.5 -
23.在一個(gè)密閉容器中,發(fā)生下列反應(yīng):CO2(g)+C(s)?2CO(g)△H>0,達(dá)到平衡后,改變下列條件,則指定物質(zhì)的濃度及平衡怎樣變化?
(1)增加C,平衡,c(CO).
(2)減小密閉容器的容積,保持溫度不變,則平衡,c(CO2).
(3)通入N2,保持密閉容器的容積和溫度不變,則平衡,c(CO2).
(4)保持密閉容器的容積不變,升高溫度,則平衡,c(CO).組卷:43引用:13難度:0.5


