2016-2017學年江西省南昌十中高一(下)晚練化學試卷(五)
發布:2024/4/20 14:35:0
一、選擇題
-
1.下列物質的性質或用途正確的是( )
A.二氧化硅是制造太陽能電池的常用材料 B.次氯酸和二氧化硫都具有漂白性,也都具有強氧化性 C.石灰石是工業上制玻璃的原料之一 D.干燥的Cl2可使濕潤的pH試紙褪色,說明Cl2具有漂白性 組卷:16引用:3難度:0.7 -
2.將足量SO2通入下列溶液中,能產生渾濁的有( )
①Ba(OH)2溶液②CaCl2溶液 ③H2S溶液 ④Ba(NO3)2溶液 ⑤Na2SiO3溶液.A.③④⑤ B.②③⑤ C.①③④⑤ D.②③④⑤ 組卷:195引用:9難度:0.7 -
3.已知下列反應:①2
+Cl2=Br2+2BrO-3②5Cl2+I2+6H2O=2HIO3+10HCl ③ClO-3+5Cl-+6H+=3Cl2+3H2O判斷下列物質氧化能力強弱順序正確的是( )ClO-3A. >ClO-3>BrO-3>Cl2IO-3B. >ClO-3>Cl2>BrO-3IO-3C. >BrO-3>Cl2>ClO-3IO-3D.Cl2> >BrO-3>ClO-3IO-3組卷:187引用:9難度:0.7 -
4.向CuSO4溶液中逐滴加入KI溶液至過量,觀察到產生白色沉淀CuI,溶液變為棕色.再向反應后的混合物中不斷通入SO2氣體,溶液逐漸變成無色.下列分析正確的是( )
A.上述實驗條件下,物質的氧化性:Cu2+>I2>SO2 B.通入SO2時,SO2與I2反應,I2作還原劑 C.通入SO2后溶液逐漸變成無色,體現了SO2的漂白性 D.滴加KI溶液時,轉移2 mol e-時生成1 mol白色沉淀 組卷:225引用:24難度:0.7 -
5.為了除去NO、NO2、N2O4對大氣的污染,常采用氫氧化鈉溶液進行吸收處理(反應方程式:3NO2+2NaOH→NaNO3+NaNO2+H2O;NO2+NO+2NaOH→2NaNO2+H2O).現有由amolNO、bmolNO2、cmolN2O4組成的混合氣體恰好被VL氫氧化鈉溶液吸收(無氣體剩余),則此氫氧化鈉溶液的物質的量濃度最小為( )
A. mol?L-1a+b+cVB. mol?L-12(a+b+c)3VC. mol?L-1a+b+2cVD. mol?L-1b+2cV組卷:52引用:11難度:0.7 -
6.下列關于氯水的敘述,正確的是( )
A.新制氯水中只含Cl2和H2O分子 B.新制氯水可使藍色石蕊試紙先變紅后褪色 C.光照氯水有氣泡逸出,該氣體是Cl2 D.氯水放置數天后漂白能力會增強 組卷:17引用:3難度:0.9
二、非選擇題
-
17.某校化學實驗興趣小組為了探究在實驗室制備Cl2的過程中有水蒸氣和HCl揮發出來,同時證明氯氣的某些性質,甲同學設計了如圖所示的實驗裝置(支撐用的鐵架臺省略),按要求回答問題.
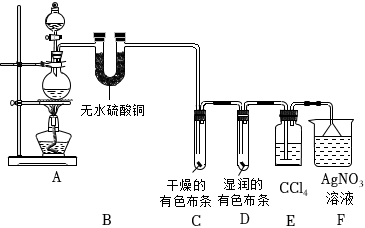
(1)寫出A中發生的化學方程式:
(2)若用含有0.2mol HCl的濃鹽酸與足量的MnO2反應制取Cl2,制得的Cl2體積(標準狀況下)總是小于1.12L的原因是.
(3)①裝置B的作用是,現象是.
②裝置C和D出現的不同現象說明的問題是.
③裝置E的作用是.
④寫出裝置F中發生反應的離子方程式.
(4)乙同學認為甲同學的實驗有缺陷,不能確保最終通入AgNO3溶液中的氣體只有一種.為了確保實驗結論的可靠性,證明最終通入AgNO3溶液的氣體只有一種,乙同學提出在某兩個裝置之間再加一個裝置.你認為該裝置應加在與之間(填裝置字母序號),裝置中應放.組卷:22引用:2難度:0.3 -
18.實驗室可用如下裝置(略去部分夾持儀器)制取SO2并驗證其性質.
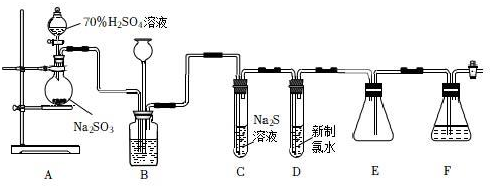
(1)盛裝70%H2SO4溶液的儀器名稱為.儀器組裝完成后,關閉兩端活塞,向裝置B的長頸漏斗內注入液體至形成一段液柱,若,則整個裝置氣密性良好.
(2)裝置B的作用之一是通過觀察產生氣泡的多少判斷SO2生成的快慢,其中的液體最好選擇(填代號).
a.蒸餾水 b.飽和Na2CO3溶液 c.飽和NaHSO3溶液 d.飽和NaOH溶液
(3)C試管中的試劑可以驗證二氧化硫的氧化性,現象為.
(4)為驗證二氧化硫的還原性,充分反應后,取試管D中的溶液分成三份,分別進行如下實驗:
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成;
方案Ⅱ:向第二份溶液中加入品紅溶液,紅色褪去;
方案Ⅲ:向第三份溶液中加入BaCl2溶液,產生白色沉淀.
上述方案合理的是方案(填“I”、“Ⅱ”或“Ⅲ”);試管D中發生反應的離子方程式為.
(5)裝置E的作用是.裝置F中為溶液.組卷:101引用:8難度:0.3


