2021年江蘇省蘇錫常鎮四市高考化學一模試卷
發布:2024/4/20 14:35:0
一、單項選擇題:本題包括13小題,每小題3分,共計39分。每小題只有一個選項最符合題意。
-
1.2020年我國已提前完成向國際社會所承諾的碳減排目標。下列措施不利于實現碳減排的是( )
A.加大化石能源占能源消費比重 B.推進綠色低碳的生產生活方式 C.開展節能減排和新能源的開發 D.加強二氧化碳的捕集和再利用 組卷:30引用:2難度:0.6 -
2.高純度HF刻蝕芯片的反應為:4HF+Si═SiF4↑+2H2O。下列有關說法正確的是( )
A.(HF)2的結構式:H-F-F-H B.H2O的比例模型: 
C.Si原子的結構示意圖: 
D.SiF4的電子式:  組卷:25引用:4難度:0.6
組卷:25引用:4難度:0.6 -
3.氧化物在生產、生活中有廣泛應用。下列氧化物的性質與用途具有對應關系的是( )
A.Al2O3有兩性,可用于制造耐高溫陶瓷 B.ClO2有氧化性,可用于自來水消毒 C.SiO2硬度大,可用于制備光導纖維 D.SO2有還原性,可用于漂白有色織物 組卷:45引用:3難度:0.6 -
4.閱讀下列資料,完成4~6題:氯氣是常用的化工原料,可用作消毒劑和漂白劑;實驗室用MnO2和鹽酸反應可制取氯氣。氯氣有毒,泄漏時需要妥善處理。
下列有關氯氣的說法不正確的是( )A.Cl2是由共價鍵構成的非極性分子 B.制備漂白粉的方法是用石灰水吸收Cl2 C.利用濕潤的淀粉-KI試紙可檢驗Cl2 D.工業上可用電解飽和食鹽水制得Cl2 組卷:20引用:0難度:0.60 -
5.閱讀下列資料,完成4~6題:氯氣是常用的化工原料,可用作消毒劑和漂白劑;實驗室用MnO2和鹽酸反應可制取氯氣。氯氣有毒,泄漏時需要妥善處理。
實驗室制取氯氣時,下列實驗能達到相應目的的是( )A. 
生成Cl2B. 
凈化Cl2C. 
收集Cl2D. 
吸收Cl2尾氣組卷:37引用:0難度:0.70
二、非選擇題:共4題,共61分。
-
16.三草酸合鐵酸鉀是制備負載型活性催化劑的主要原料,易溶于水,難溶于乙醇。實驗室制備流程如圖。

(1)制備FeC2O4?2H2O晶體。
①“溶解”時加入硫酸的目的是。
②“沉淀”得到FeC2O4?2H2O晶體,“沉淀”時發生反應的離子方程式為。
③“沉淀”時需要煮沸,其目的是。
(2)制備K3[Fe(C2O4)3]?3H2O晶體。
【查閱資料】
①K2Fe(C2O4)2溶于水;Fe2(C2O4)3難溶于水。
②實驗條件下,pH=3.2時,Fe3+沉淀完全;過氧化氫在40℃發生顯著分解。
③鐵氰化鉀(K3[Fe(CN)6])溶液與Fe2+反應產生深藍色沉淀,與Fe3+不反應。
以FeC2O4?2H2O晶體作為原料,制備K3[Fe(C2O4)3]?3H2O晶體時,請補充完整相應的實驗方案:取一定量的FeC2O4?2H2O晶體,邊加入飽和H2C2O4溶液邊攪拌,至pH約為3,,過濾、晾干、得到K3[Fe(C2O4)3]?3H2O晶體。(實驗中須使用的試劑:10% H2O2溶液,飽和K2C2O4溶液,無水乙醇,K3[Fe(CN)6]溶液。)
(3)通過下列方法測定產品純度:準確稱取1.250g K3[Fe(C2O4)3]?3H2O樣品,加入適量水溶解并用稀硫酸酸化,加熱至80℃,趁熱用0.1500mol?L-1KMnO4標準溶液滴定至終點,消耗KMnO4標準溶液18.30mL。測定過程中發生的反應為:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O。計算樣品的純度(寫出計算過程):。組卷:59引用:1難度:0.4 -
17.氮氧化物(NOx)是硝酸和肼等工業的主要污染物。采用選擇性催化還原或氧化吸收法可有效脫除煙氣中的氮氧化物。
(1)一種以沸石籠作為載體對氮氧化物進行催化還原的原理如圖1所示,A在沸石籠內轉化為B、C、D等中間體的過程如圖2所示。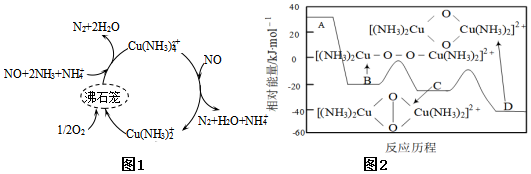
①由A到B的變化過程可表示為。
②脫除NO的總反應為。
(2)電解氧化吸收法可將廢氣中的NOx轉變為硝態氮。分別向0.1mol?L-1NaCl溶液和0.08mol?L-1Na2SO4溶液(起始pH均調至9)中通入NO,測得電流強度與NO的脫除率的關系如圖3所示。電解0.1mol?L-1NaCl溶液時,溶液中相關成分的濃度變化與電流強度的關系如圖4所示。
①電解Na2SO4溶液時產生H2O2。H2O2氧化吸收NO的離子方程式為。
②電解NaCl溶液作吸收液時,NO的去除率始終比Na2SO4溶液的大,原因是。
③隨著電流強度的增大,電解NaCl溶液時NO去除率下降的原因是。組卷:53引用:1難度:0.6


