2021-2022學年新疆喀什地區岳普湖縣高二(下)第一次調研化學試卷
發布:2024/4/20 14:35:0
一、單選題(共20小題,每小題2分,共40分)
-
1.化學與生活、生產息息相關.下列說法錯誤的是( )
A.使用含氟牙膏可以有效預防齲齒 B.堿性的鋅錳干電池屬于二次電池 C.用可溶性的鋁鹽和鐵鹽處理水中的懸浮物 D.黃銅(銅鋅合金)制作的銅鑼不易生銅銹 組卷:7引用:2難度:0.7 -
 2.Ca+金屬離子體系催化N2O和CO反應的過程不需要吸收能量,Ca+是理想的金屬陽離子催化劑。該反應的催化原理如圖所示,下列敘述錯誤的是( )
2.Ca+金屬離子體系催化N2O和CO反應的過程不需要吸收能量,Ca+是理想的金屬陽離子催化劑。該反應的催化原理如圖所示,下列敘述錯誤的是( )A.該反應的決速步驟為IM4→IM5 B.Ca+作該反應的催化劑時降低了反應的活化能 C.催化過程中N2O發生的反應為N2O+Ca+═N2+CaO+ D.N2O和CO反應的熱化學方程式為N2O+CO═N2+CO2ΔH=-43.49kJ/mol 組卷:30引用:3難度:0.5 -
 3.常溫下,pH=10的M、N兩種堿溶液各1mL,分別加水稀釋到100mL,其pH與溶液體積的關系如圖所示,下列說法正確的是( )
3.常溫下,pH=10的M、N兩種堿溶液各1mL,分別加水稀釋到100mL,其pH與溶液體積的關系如圖所示,下列說法正確的是( )A.稀釋前,兩溶液中n(OH-)不等 B.稀釋后,M溶液的堿性比N溶液的堿性強 C.完全中和M、N溶液時,消耗同濃度鹽酸的體積相等 D.若8<a<10,則M、N都是弱堿 組卷:5引用:4難度:0.7 -
4.HCOOH是一種弱酸,常溫下,對HCOOH溶液進行稀釋,下列物理量的比值增大的是( )
A. c(HCOOH)c(HCOO-)B.c(HCOO-)? c(H+)c(HCOOH)C. c(H+)c(HCOOH)D. c(HCOO-)c(HCOOH)c(OH-)組卷:34引用:2難度:0.6 -
5.一定溫度下,反應:2SO2(g)+O2(g)
2SO3(g)的反應熱和化學平衡常數分別為△H和K,△H<0,下列說法正確的是( )催化劑△A.升高溫度,K增大 B.2molSO2和1molO2反應放出熱量|△H| C.其他條件不變,增大SO2的量,△H和K均增大 D.相同溫度時反應4SO3(g) 4SO2(g)+2O2(g)的反應熱和化學平衡常數為-2△H和催化劑△1K2組卷:4引用:3難度:0.6 -
6.如圖所示能夠組成原電池,并且產生明顯的電流的是( )
A. 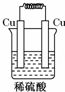
B. 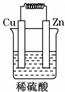
C. 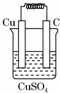
D. 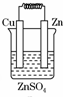 組卷:21引用:6難度:0.9
組卷:21引用:6難度:0.9 -
7.HA是一元弱酸,微溶鹽MA2的飽和溶液中c(M2+)隨c(H+)而變化,M2+不發生水解。定義如下關系:pM=-lgc(M2+),δ(A-)=
。25℃時,實驗測得pM與δ(A-)的關系如圖所示,其中D點對應的pH=5.0。已知lg2≈0.3,則下列說法正確的是( )c(A-)c(A-)+c(HA)
A.D點存在2c(M2+)=3c(HA) B.E點的pH≈5.6 C.25℃時,Ksp(MA2)的數量級為10-10 D.25℃時,HA的電離常數:Ka為2.5×10-5 組卷:46引用:2難度:0.5 -
8.設NA為阿伏加德羅常數的值,下列說法正確的是( )
A.常溫下1LpH=3的FeCl3溶液中Cl-數目為3NA B.標況下2.24LCl2溶于水充分反應后,HClO、ClO-、Cl-微粒數目之和為0.2NA C.向1L0.1mol?L-1的NH4Cl溶液中通入NH3使溶液呈中性,含有NH4+數目為0.1NA D.粗銅精煉過程中,當陽極質量減小64g時,轉移電子數目為2NA 組卷:4引用:2難度:0.6
二、綜合題,共60分
-
24.正確認識和使用電池有利于我們每一個人的日常生活。
I.電化學法處理SO2是目前研究的熱點。利用雙氧水氧化吸收SO2可消除SO2污染,設計裝置如圖所示(已知石墨只起導電作用,質子交換膜只允許H+通過)。
(1)石墨1為(填“正極”或“負極”),正極的電極反應式為。
(2)反應的總方程式為。
(3)H+的遷移方向為由到。(填“左”或“右”)
(4)若11.2L(標準狀況)SO2參與反應,則遷移H+的物質的量為。
(5)某同學關于原電池的筆記中,不合理的有。
①原電池兩電極材料活潑性一定不同
②原電池負極材料參與反應,正極材料都不參與反應
③Fe-NaOH溶液-Si原電池,Fe是負極
④原電池是將化學能轉變為電能的裝置
Ⅱ.航天技術中使用的氫氧燃料電池具有高能、輕便和不污染環境等優點。氫氧燃料電池有多種。
(1)某堿式氫氧燃料電池的電解質溶液是KOH溶液,則其負極反應為;某熔鹽氫氧燃料電池的電解質是熔融的碳酸鉀,則其負極反應為。
(2)氫氧燃料電池用于航天飛船,電極反應產生的水,經過冷凝后可用作航天員的飲用水,當得到1.8g飲用水時,轉移的電子數約為。組卷:13引用:1難度:0.6 -
25.現有濃度均為0.1mol/L的下列溶液:①硫酸 ②醋酸 ③氫氧化鈉 ④氯化銨
請回答下列問題:
(1)①②③④四種溶液中由水電離出的H+濃度由大到小的順序是(填序號).
(2)將③和④等體積混合后,混合液中各離子濃度由大到小的順序是.
(3)已知t℃,KW=1×10-13,則t℃(填“>”、“<”或“=”)25℃.在t℃時將pH=11的NaOH溶液a L與pH=1的H2SO4溶液b L混合(忽略混合后溶液體積的變化),若所得混合溶液的pH=10,則a:b=.
(4)25℃時,有pH=x的鹽酸和pH=y的氫氧化鈉溶液(x≤6,y≥8),取a L該鹽酸與b L該氫氧化鈉溶液反應,恰好完全中和,求:
①若x+y=14,則a/b=(填數據);
②若x+y=13,則a/b=(填數據);
③若x+y>14,則a/b=(填表達式);
④該鹽酸與該氫氧化鈉溶液完全中和,兩溶液的pH(x、y)的關系式為(填表達式).組卷:47引用:4難度:0.5


