2020-2021學年湖北省襄陽市某校高一(下)調研化學試卷(5月份)
發布:2024/4/20 14:35:0
一、選擇題
-
1.下列物質不屬于有機物的是( )
A.嫦娥五號上的“織物版”國旗使用的國產高性能材料——芳綸纖維 B.“中國天眼”傳輸信息用的光纖材料——光導纖維 C.“一箭四星”運載火箭發動機使用的高效固態推進劑——二聚酸二異氰酸酯 D.新冠肺炎疫情期間醫用防護服使用的防水透濕功能材料——聚氨酯薄膜 組卷:11引用:3難度:0.8 -
 2.下列反應中反應過程的能量變化與圖示不相符的是( )
2.下列反應中反應過程的能量變化與圖示不相符的是( )A.C+CO2 2CO點燃B.C+O2 2CO2點燃C.H2+Cl2 2HCl點燃D.Mg+2HCl=MgCl2+H2↑ 組卷:42引用:3難度:0.7 -
3.對下列六種物質的描述不正確的是( )
①CH3Cl
②CH2=CHCH3
③CH2ClCH2CH2Cl
④CH3CH2CH2Cl
⑤CH3CH2CH2CH3
⑥CH3CH(CH3)2A.②⑤⑥屬于烴類化合物 B.①和④互為同系物 C.②與Cl2發生加成反應可生成③ D.⑤和⑥互為同分異構體 組卷:68引用:5難度:0.3 -
 4.NH3是一種重要的化工原料,在半導體光催化的作用下,N2分子被光催化材料捕獲進而實現N2→NH3的轉化(過程如圖)。下列說法錯誤的是( )
4.NH3是一種重要的化工原料,在半導體光催化的作用下,N2分子被光催化材料捕獲進而實現N2→NH3的轉化(過程如圖)。下列說法錯誤的是( )A.N2在光催化材料表面斷開了N≡N鍵 B.該反應中,N2被還原 C.該反應過程中有舊化學鍵斷裂和新化學鍵形成 D.該反應的類型是化合反應 組卷:7引用:3難度:0.7 -
 5.理論上任何自發的氧化還原反應都可以設計成原電池。下列能設計成原電池且b極質量增加的是( )
5.理論上任何自發的氧化還原反應都可以設計成原電池。下列能設計成原電池且b極質量增加的是( )選項 a極 b極 X溶液 A C Fe 稀硫酸 B Cu Ag 酒精 C Zn Cu FeCl3溶液 D Fe Ag CuSO4溶液 A.A B.B C.C D.D 組卷:20引用:3難度:0.5 -
6.足球比賽中當運動員肌肉挫傷或扭傷時,隊醫會迅速給運動員的受傷部位噴射一種藥劑--氯乙烷(沸點為12.27℃)進行局部冷凍麻醉應急處理。下列制取氯乙烷(CH3CH2Cl)的方法中最好的是( )
A.乙烯與HCl反應 B.乙烯與氯氣反應 C.乙烷與HCl反應 D.乙烷與氯氣反應 組卷:99引用:7難度:0.6
二、解答題)
-
18.在一定條件下,CO2可與H2發生反應生成甲醇,反應的化學方程式為CO2(g)+3H2(g)?CH3OH(g)+H2O(g)。根據所學知識,回答下列問題:
(1)CO2和H2在某催化劑表面合成甲醇的反應歷程如圖所示,由此判斷CO2(g)+3H2(g)?CH3OH(g)+H2O(g)是(填“吸熱”或“放熱”)反應。
(2)若以CO2表示的該反應的化學反應速率為0.2mol?L-1?min-1,則以H2表示的該反應的化學反應速率為mol?L-1?min-1。
(3)恒溫條件下,在2L的恒容密閉容器中,充入2molCO2和3molH2,在一定條件下發生反應。
①3s末測得CO2的物質的量為1.6mol,此時容器內CH3OH的物質的量濃度為mol?L-1,c(CO2):c(H2)=。
②一段時間后,能說明該反應已達到平衡狀態的是(填標號)。
a.c(CO2):c(H2O)
b.容器內壓強保持不變
c.3v逆(CH3OH)=v正(H2)
d.容器內混合氣體的密度保持不變
③若反應在ts后達到平衡,測得H2轉化了50%,則平衡時CO2的體積分數為。
④CH3OH是一種重要的化工產品。通過上述反應獲得CH3OH是一種重要的途徑,下列有關說法中正確的是(填標號)。
a.該反應為可逆反應,故在一定條件下CO2和H2不可能全部轉化為CH3OH
b.達到平衡后,反應就停止了,故此時正、逆反應速率相等且均為0
c.在利用上述反應生產CH3OH時,要同時考慮反應所能達到的限度和化學反應速率兩方面的問題組卷:5引用:3難度:0.6 -
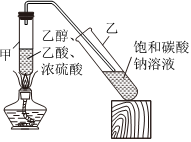 19.乙酸乙酯是一種重要的有機化工原料和工業溶劑,具有低毒性,有甜味,濃度較高時有刺激性氣味,易揮發,屬于一級易燃品,應儲存于低溫通風處,遠離火種火源。實驗室一般通過乙酸和乙醇的酯化反應來制取,實驗裝置如圖所示(夾持裝置已省略),主要步驟如下:
19.乙酸乙酯是一種重要的有機化工原料和工業溶劑,具有低毒性,有甜味,濃度較高時有刺激性氣味,易揮發,屬于一級易燃品,應儲存于低溫通風處,遠離火種火源。實驗室一般通過乙酸和乙醇的酯化反應來制取,實驗裝置如圖所示(夾持裝置已省略),主要步驟如下:
①在甲試管中加入2mL濃硫酸、2mL乙酸和3mL乙醇,再加入幾片碎瓷片。
②按圖連接好裝置(裝置的氣密性良好),小火均勻地加熱3~5min③待乙試管收集到一定量產物后停止加熱,撤出乙試管并用力振蕩,然后靜置待分層。
④分離出乙酸乙酯層,洗滌、干燥,得乙酸乙酯產品。
(1)寫出上述實驗中生成乙酸乙酯反應的化學方程式:。乙試管中長玻璃導管的作用是。
(2)甲試管中,混合溶液的加入順序為(填化學式)。
(3)步驟②中需要用小火均勻加熱,其主要原因是。
(4)為了證明濃硫酸在該反應中起到了催化劑和吸水劑的作用,某同學利用上述實驗裝置進行下列3組實驗。實驗開始時先用酒精燈微熱甲試管中的試劑3min,再加熱使之微微沸騰3min。實驗結束后,充分振蕩乙試管并測其有機層的厚度,實驗數據記錄如下:
①實驗C中a=實驗
組號甲試管中試劑 乙試管
中試劑有機
層的
厚度A 3mL乙醇、2mL乙酸、3mL18mol?L-1濃硫酸 飽和
Na2CO3溶液3.0 B 3mL乙醇、2mL乙酸、3mL H2O 0.1 C 3mL乙醇、2mL乙酸、
a mL2mol?L-1 H2SO4溶液0.6 。
②分析實驗(填字母)的數據,可以推測出濃H2SO4的吸水性提高了乙酸乙酯的產率。
③已知:乙酸的密度為1.05g?cm-3,乙醇的密度為0.789g?cm-3,實驗A收集到的乙酸乙酯的質量為2.464g。則該反應中產品的產率為。(產率=實際產量理論產量×100%)組卷:29引用:4難度:0.7


