2021-2022學(xué)年河北省邯鄲市八校聯(lián)盟(永年一中、大化一中等)高二(上)期中化學(xué)試卷
發(fā)布:2024/11/26 18:30:2
一、選擇題:本題共9小題,每小題3分,共27分。在每小題給出的四個(gè)選項(xiàng)中,只有一項(xiàng)是符合題目要求的。.
-
1.化學(xué)與生產(chǎn)、生活密切相關(guān),下列說法正確的是( )
A.H2燃燒過程中熱能轉(zhuǎn)化為化學(xué)能 B.冶煉鐵的原料之一赤鐵礦的主要成分為四氧化三鐵 C.鍍錫鐵皮的鍍層破損后,比不鍍錫的鐵皮更加容易腐蝕 D.聚氯乙烯可通過加聚反應(yīng)制得,用于制作不粘鍋的耐熱涂層 組卷:2引用:4難度:0.7 -
2.如圖所示裝置中,能形成原電池且溶液會(huì)變藍(lán)的是( )
A. 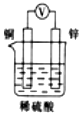
B. 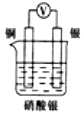
C. 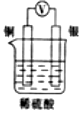
D. 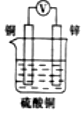 組卷:26引用:3難度:0.5
組卷:26引用:3難度:0.5 -
 3.下列反應(yīng)的能量變化與示意圖不相符的是( )
3.下列反應(yīng)的能量變化與示意圖不相符的是( )A.生石灰與水的反應(yīng) B.灼熱的炭與水蒸氣的反應(yīng) C.鹽酸和碳酸氫鈉的反應(yīng) D.氫氧化鋇與氯化銨的反應(yīng) 組卷:5引用:2難度:0.6 -
4.常溫下,下列電解質(zhì)在水中電離的電離方程式正確的是( )
A.HF?H++F- B.H2S?2H++S2- C.Ca(HCO3)2?Ca2++2HCO3- D.K2SO3?SO32-+2K+ 組卷:48引用:8難度:0.7 -
5.根據(jù)原電池原理,下列反應(yīng)不能設(shè)計(jì)成原電池的是( )
A.2CH3OH+3O2 2CO2+4H2O點(diǎn)燃B.Fe+CuSO4=FeSO4+Cu C.HCl+NaOH=H2O+NaCl D.2H2S+SO2=3S↓+2H2O 組卷:23引用:3難度:0.7
三、非選擇題:本題共4小題,共57分。
-
16.1909年,化學(xué)家哈伯用N2和H2在高溫高壓條件下首次合成了氨氣,反應(yīng)原理為N2(g)+3H2(g)?2NH3(g),該反應(yīng)的能量變化如圖1所示(a、b均大于零),回答下列問題:
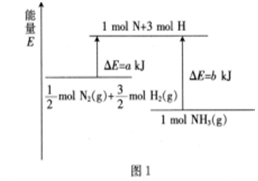
(1)根據(jù)圖1寫出生成2molNH3時(shí)的熱化學(xué)方程式:。
(2)在500°C、30MPa下,斷裂1molH-H鍵、1molN-H鍵、1molN≡N鍵需要吸收的能量分別為436 kJ、391kJ、946kJ。
①每消耗0.5molN2該反應(yīng)放出的熱量為。
②向某一密閉容器中充入1.5molH2(g)和0.5molN2 (g),在催化劑條件下進(jìn)行上述反應(yīng),此時(shí)斷裂的H-H鍵吸收的熱量(填“>”,“<”或“=”)436×1.5=654 (kJ)。
(3)一種用電化學(xué)法合成氨的原理裝置如圖2所示: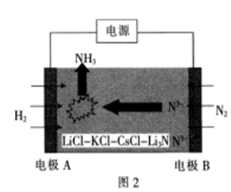
①電極B的名稱是(填“陰極”或“陽(yáng)極”)。
②圖2中陽(yáng)極的電極反應(yīng)式為。
③若圖2中支持電解質(zhì)改為質(zhì)子導(dǎo)體陶瓷膜,則陰極的電極反應(yīng)式為。組卷:6引用:3難度:0.6 -
17.已知下列兩個(gè)反應(yīng):
反應(yīng)Ⅰ:CO2(g)+H2(g)?CO(g)+H2O(g)△H1
反應(yīng)Ⅱ:CO(g)+H2O(g)?CO2(g)+H2(g)△H2
反應(yīng)Ⅰ的化學(xué)平衡常數(shù)K1與溫度的關(guān)系如下表所示:
請(qǐng)回答下列問題:T/K 500 750 1000 1300 K1 0.4 0.64 1 1.5
(1)若反應(yīng)Ⅱ的化學(xué)平衡常數(shù)為K2,則500K時(shí),K2=。
(2)反應(yīng)Ⅰ的△H1(填“>”、“<”或“=”)0,若壓縮容器體積,H2的平衡轉(zhuǎn)化率(填“增大”、“減小”或“不變”)。
(3)溫度為750K時(shí),向某恒容密閉容器中通入一定量的CO和H2O進(jìn)行反應(yīng)Ⅱ,下列能判斷反應(yīng)Ⅱ已達(dá)到平衡的依據(jù)是(填標(biāo)號(hào))。
A.容器中的壓強(qiáng)不再改變
B.混合氣體的密度不再改變
C.每斷裂1molH-H鍵,同時(shí)斷裂2molH-O鍵
D.c(CO2):c(H2):c(CO):c(H2O)=5:5:4:4
(4)向容積為5L的絕熱恒容密閉容器中通入0.5mol CO2和0.3mol H2進(jìn)行反應(yīng),30s時(shí)反應(yīng)達(dá)到平衡,此時(shí)CO2的轉(zhuǎn)化率為37.5%,則0~30s內(nèi),該反應(yīng)的平均反應(yīng)速率v(H2)=mol?L-1?min-1,該反應(yīng)起始溫度為(填具體數(shù)值或范圍,下同);若起始時(shí)將絕熱恒容密閉容器改為恒溫恒容密閉容器,其他條件不變,則CO2的平衡轉(zhuǎn)化率α為。組卷:9引用:4難度:0.5


