2013-2014學年廣東省深圳中學高二(下)化學暑假作業(八)
發布:2024/4/20 14:35:0
一、選擇題
-
1.在密閉容器中,對于反應:2SO2(g)+O2(g)?2SO3(g),SO2和O2起始時分別為20mol和10mol;達平衡時,SO2的轉化率為80%.若從SO3開始進行反應,在相同的溫度下,欲使平衡時各成分的百分含量與前者相同,則起始時SO3的物質的量及其轉化率為( )
A.10 mol和10% B.20 mol和20% C.20 mol和40% D.20 mol和80% 組卷:61引用:24難度:0.9 -
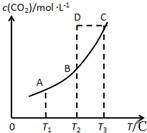 2.在密閉容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g);CO2(g)的平衡物質的量濃度c(CO2)與溫度T的關系如圖.下列說法錯誤的是( )
2.在密閉容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g);CO2(g)的平衡物質的量濃度c(CO2)與溫度T的關系如圖.下列說法錯誤的是( )A.平衡狀態A與C相比,平衡狀態A的c(CO)小 B.在T2時,若反應處于狀態D,則一定有V正<V逆 C.反應CO(g)+H2O(g)?CO2(g)+H2(g) 的△H>0 D.若T1、T2時的平衡常數分別為K1、K2,則K1<K2 組卷:42引用:13難度:0.7 -
3.一定條件下,可逆反應X(g)+3Y(g)?2Z(g),若X、Y、Z起始濃度分別為c1、c2、c3(均不為0,單位mol/L),當達平衡時X、Y、Z的濃度分別為0.1mol/L,0.3mol/L,0.08mol/L,則下列判斷不合理的是( )
A.c1:c2=1:3 B.平衡時,Y和Z的生成速率之比為3:2 C.X、Y的轉化率不相等 D.c1的取值范圍為0<c1<0.14mol/L 組卷:119引用:42難度:0.7 -
4.已知圖①~④的相關信息,下列相應敘述正確的是( )
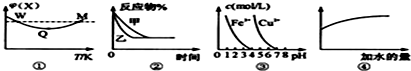
A.圖①表示向恒容密閉容器中充入X和Y發生反應:2X(g)+Y(g)?3Z(g)ΔH<0,W點X的正反應速率等于M點X的正反應速率 B.圖②表示壓強對可逆反應A(g)+2B(g)?3C(g)+D(s)的影響,乙的壓強比甲的壓強小 C.據圖③,若要除去CuSO4溶液中的Fe3+,可加入NaOH溶液至pH在4左右 D.常溫下,稀釋0.1mol/L Na2CO3溶液,圖④中的縱坐標可表示溶液中HCO3-的數目 組卷:91引用:5難度:0.7 -
5.淺綠色的Fe(NO3)2溶液中存在著如下的平衡:Fe2++2H2O?Fe(OH)2+2H+若在此溶液中加入鹽酸,則溶液的顏色變化為( )
A.綠色變深 B.淺綠色變得更淺 C.變黃 D.無明顯變化 組卷:51引用:7難度:0.9 -
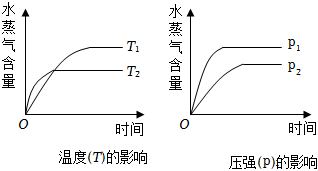 6.一定條件下,下列反應中水蒸氣含量隨反應時間的變化趨勢符合題圖的是( )
6.一定條件下,下列反應中水蒸氣含量隨反應時間的變化趨勢符合題圖的是( )A.CO2(g)+2NH3(g)?CO(NH2)2(s)+H2O(g)△H<0 B.CO2(g)+H2(g)?CO(g)+H2O(g)△H>0 C.CH3CH2OH(g)?CH2=CH2(g)+H2O(g)△H>0 D.2C6H5CH2CH3(g)+O2(g)?2C6H5CH=CH2(g)+2H2O(g)△H<0 組卷:224引用:58難度:0.7 -
7.N2+3H2
2NH3,是工業上制造氮肥的重要反應.下列關于該反應的說法正確的是( )催化劑A.增加N2的濃度能加快反應速率 B.降低體系溫度能加快反應速率 C.使用催化劑不影響反應速率 D.若反應在密閉容器中進行,N2和H2能100%轉化為NH3 組卷:75引用:10難度:0.9
二、解答題
-
22.捕碳技術(主要指捕獲CO2)在降低溫室氣體排放中具有重要的作用.目前NH3和(NH4)2CO3已經被用作工業捕碳劑,它們與CO2可發生如下可逆反應:
反應Ⅰ:2NH3(l)+H2O(l)+CO2(g)?(NH4)2CO3(aq)△H1
反應Ⅱ:NH3(l)+H2O(l)+CO2(g)?NH4HCO3(aq)△H2
反應Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)?2NH4HCO3(aq)△H3
請回答下列問題:
(1)△H3與△H1、△H2之間的關系是:△H3=.
(2)反應Ⅲ的化學平衡常數表達式為.
(3)為研究溫度對(NH4)2CO3捕獲CO2效率的影響,在某溫度T1下,將一定量的(NH4)2CO3溶液置于密閉容器中,并充入一定量的CO2氣體(用氮氣作為稀釋劑),在t時刻,測得容器中CO2氣體的濃度.然后分別在溫度為T2、T3、T4、T5下,保持其他初始實驗條件不變,重復上述實驗,經過相同時間測得CO2氣體濃度,得到趨勢圖(見圖1).則:
①△H30(填“>”、“=”或“<”).
②在T1~T2及T4~T5兩個溫度區間,容器內CO2氣體濃度呈現如圖1所示的變化趨勢,其原因是.
③反應Ⅲ在溫度為T1時,溶液pH隨時間變化的趨勢曲線如圖2所示.當時間到達t1時,將該反應體系溫度迅速上升到T2,并維持該溫度.請在該圖中畫出t1時刻后溶液的pH變化總趨勢曲線.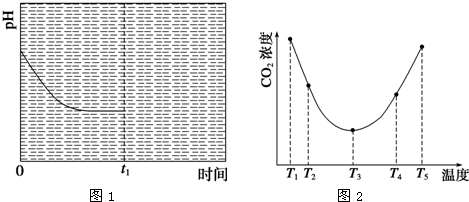
(4)利用反應Ⅲ捕獲CO2,在(NH4)2CO3初始濃度和體積確定的情況下,提高CO2吸收量的措施有
(5)下列物質中也可以作為CO2捕獲劑的是.
A.NH4Cl B.Na2CO3 C.HOCH2CH2OH D.HOCH2CH2NH2.組卷:13引用:3難度:0.5 -
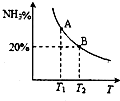 23.合成氨技術的發明使工業化人工固氮成為現實.
23.合成氨技術的發明使工業化人工固氮成為現實.
(1)已知N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ?mol-1.在一定條件下反應時,當生成標準狀況下33.6L NH3時,放出的熱量為.
(2)合成氨混合體系在平衡狀態時NH3的百分含量與溫度的關系如圖所示.由圖可知:
①溫度T1、T2時的平衡常數分別為K1、K2,則K1K2 (填“>”或“<”).若在恒溫、恒壓條件下,向平衡體系中通入氦氣,平衡移動(填“向左”、“向右”或“不”).
②T2溫度時,在1L的密閉容器中加入2.1mol N2、1.5mol H2,經10min達到平衡,則v(H2)=.達到平衡后,如果再向該容器內通入N2、H2、NH3各0.4mol,則平衡移動(填“向左”、“向右”或“不”).
(3)工業上用CO2和NH3反應生成尿素:CO2(g)+2NH3(g)?H2O(l)+CO(NH2)2(l)△H,
在一定壓強下測得如下數據:
①則該反應△H溫度/℃
CO2轉化率%n(NH3)n(CO2)100 150 200 1 19.6 27.1 36.6 1.5 a b c 2 d e f 0,表中數據ad,bf(均選填“>”、“=”或“<”).
②從尿素合成塔內出來的氣體中仍含有一定量的CO2、NH3,應如何處理.組卷:7引用:2難度:0.5


