2022年北京市豐臺區高考化學二模試卷
發布:2024/4/20 14:35:0
一、本部分共14題,每題3分,共42分。在每題列出的四個選項中,選出最符合題目要求的一項。
-
1.制作豆腐的流程中,屬于過濾操作的是( )
A. 
泡豆B. 
磨漿C. 
濾渣D. 
煮漿點兌組卷:29引用:1難度:0.8 -
2.用下列裝置完成相關實驗,不合理的是( )
A. 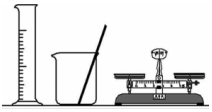
配制100mL1.00mol?L-1NaCl溶液B. 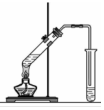
制備少量乙酸乙酯C. 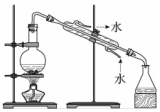
蒸餾海水得到淡水D. 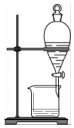
分離Na2CO3溶液與CH3COOC2H5組卷:33引用:1難度:0.7 -
3.對下列事實的解釋,方程式不正確的是( )
A.氯水保存于棕色試劑瓶:2HClO H2↑+Cl2↑+O2↑光B.不能用排水法收集NO2:3NO2+H2O═2HNO3+NO C.高溫熔融態鐵遇水爆炸:3Fe+4H2O Fe3O4+4H2,2H2+O2高溫2H2O高溫D.硫酸鋁與碳酸氫鈉制泡沫滅火器:Al3++3HCO3-═Al(OH)3↓+3CO2↑ 組卷:174引用:1難度:0.5 -
4.下列物質的用途涉及氧化還原反應的是( )
A.用NaHCO3作食品膨松劑 B.用暖寶貼(成分:鐵粉、水、食鹽、活性炭等)供熱 C.用飽和Na2CO3溶液和鹽酸處理水垢中的CaSO4 D.用可溶性的鐵鹽、鋁鹽作凈水劑 組卷:99引用:1難度:0.7 -
5.下列事實不是由于分子的極性導致的是( )
A.N2的沸點比CO低 B.常溫常壓下,CO2為氣體,CS2為液體 C.HCl氣體易溶于水 D.用毛皮摩擦過的橡膠棒靠近水流,水流方向發生變化 組卷:70引用:3難度:0.7 -
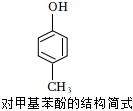 6.對甲基苯酚用于制作除草劑、醫藥上的消毒劑、香料。下列說法不正確的是( )
6.對甲基苯酚用于制作除草劑、醫藥上的消毒劑、香料。下列說法不正確的是( )A.可與NaOH、Na2CO3發生反應 B.核磁共振氫譜峰面積之比為1:2:2:3 C.可與甲醛發生縮聚反應,與Br2發生取代反應 D.含有苯環的同分異構體共有3種(不包含對甲基苯酚) 組卷:59引用:1難度:0.7
二、本部分共5題,共58分。
-
18.具有廣泛生物活性的某丁內酯類化合物K的合成路線如圖:
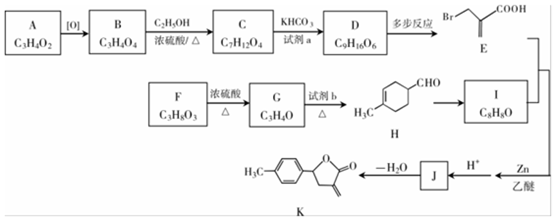
已知:
i.R1CH2COOR2+R3CHOKHCO3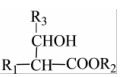
ii.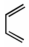 +
+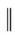 △
△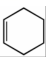
iii.R-Br+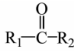 Zn乙醚H+
Zn乙醚H+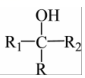
(1)A能發生銀鏡反應,A中官能團名稱是。
(2)B→C的化學方程式為。
(3)C+2aD,則試劑a是KHCO3。
(4)已知:同一個碳原子連有2個羥基的分子不穩定,F為醇類。F→G的化學方程式為。
(5)試劑b的結構簡式為。
(6)H→I的反應類型為,J 的結構簡式為。
(7)已知: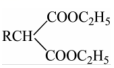 H+/H2O△RCH2COOH,將D→E的流程圖補充完整,在( )內填寫試劑和條件,在-CO2
H+/H2O△RCH2COOH,將D→E的流程圖補充完整,在( )內填寫試劑和條件,在-CO2 方框內填寫物質的結構簡式。
方框內填寫物質的結構簡式。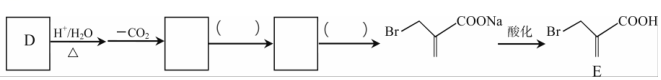 組卷:46引用:1難度:0.5
組卷:46引用:1難度:0.5 -
19.某小組進行如下實驗:向0.1mol?L-1FeCl3溶液中通入SO2或加入Na2SO3溶液,均得到紅色溶液。
已知:溶液中+4價含硫微粒物質的量分數隨pH變化的曲線如圖所示。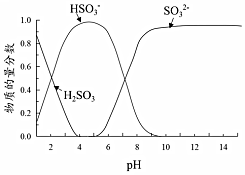
I.推測Fe3+與溶液中的某種+4價含硫微粒形成了紅色的配離子。設計如下實驗(均在常溫下進行):
(1)將上述實驗補充完整。實驗 溶液1(1mL) 溶液2(10mL) 現象 A 0.1mol?L-1FeCl3溶液 SO2的飽和溶液 溶液1與溶液2混合后,實驗A、B、C所得溶液紅色依次加深 B 0.1mol?L-1FeCl3溶液 SO2的飽和溶液,用NaOH固體調pH=5.0 C 0.1mol?L-1FeCl3溶液
(2)配離子的配體為SO32-的實驗證據是。
II.探究pH對FeCl3和Na2SO3反應的影響。設計如下實驗:
(3)探究實驗b中溶液褪色更快的原因:序號 實驗a 實驗b 方案 5mL酸化的0.1mol?L-1FeCl3與2mL0.1mol?L-1Na2SO3混合得紅色溶液,測得pH=1.7 5mL酸化的0.1mol?L-1FeCl3與2mL0.1mol?L-1Na2SO3混合得紅色溶液,加幾滴濃鹽酸,調pH=1.3 現象 放置10分鐘后,溶液紅色均褪去,實驗b中溶液褪色更快。經檢驗,褪色后的溶液中均存在Fe2+。
i.甲認為pH降低,有利于Fe3+氧化SO32-,導致實驗b中溶液褪色更快。
①從電極反應的角度,進行理論分析:還原反應為:Fe3++e-═Fe2+氧化反應為:。
②已知上述實驗條件下pH對Fe3+的氧化性幾乎沒有影響。從平衡移動的角度判斷pH對SO32-還原性的影響是(填“增強”或“減弱”)。
③通過理論分析,甲認為其猜測(填“成立”或“不成立”),并進一步實驗,獲得了證據。實驗方案為:反應相同時間,分別取實驗a和b中的溶液,檢測濃度(填離子符號),比較其大小關系。
ii.乙猜測pH降低,有利于氧化SO32-,導致實驗b中溶液褪色更快。
④將乙的假設補充完整(填化學式)。
⑤乙設計實驗進行驗證:
取10mL0.1mol?L-1Na2SO3溶液加硫酸調pH=1.7,用KMnO4溶液滴定,消耗體積為V1。另取一份相同的溶液放置10分鐘后,再用KMnO4溶液滴定,消耗體積為V2。前后差值(V1-V2)為ΔVa。用同樣的方法對10mL0.1mol?L-1Na2SO3(含H2SO4)pH=1.3進行滴定,消耗KMnO4溶液前后體積差值為ΔVb。經對比可知,ΔVa>ΔVb,由此得出的實驗結論是。
(4)綜合上述分析,pH降低,有利于反應的發生,導致實驗b中溶液褪色更快。組卷:107引用:2難度:0.6


