2021-2022學(xué)年遼寧省營(yíng)口市普通高中高二(上)期末化學(xué)試卷
發(fā)布:2024/12/21 7:0:2
一、選擇題(本題包括15小題,每小題3分,共45分,每小題只有一個(gè)選項(xiàng)符合題意)
-
1.下列裝置或過(guò)程能實(shí)現(xiàn)電能轉(zhuǎn)化為化學(xué)能的是( )
A. 
鋅錳干電池B. 
燃?xì)馊紵?/span>C. 
電池充電D. 
水力發(fā)電組卷:75引用:7難度:0.7 -
2.習(xí)主席在十九大報(bào)告中指出:“綠水青山就是金山銀山”。下列做法不利于環(huán)境保護(hù)的是( )
A.開(kāi)發(fā)清潔能源,提高能源的利用率 B.對(duì)廢電池做深埋處理 C.使用Na2S做沉淀劑可以去除工業(yè)廢水中的Cu2+、Hg2+等 D.施用適量石膏(CaSO4?2H2O)可降低鹽堿地(含較多NaCl、Na2CO3)的堿性 組卷:4引用:1難度:0.6 -
3.向水中加入下列溶質(zhì),能促進(jìn)水電離的是( )
A.H2SO4 B.NaOH C.NaCl D.NH4Cl 組卷:86引用:3難度:0.8 -
4.下列溶液一定顯酸性的是( )
A.c(H+)>c(OH-) B.含有H+ C.pH<7 D.酚酞變紅 組卷:55引用:6難度:0.8 -
5.下列敘述正確的是( )
A.  可表示單核10電子粒子基態(tài)時(shí)的電子排布圖
可表示單核10電子粒子基態(tài)時(shí)的電子排布圖B.2s的電子云半徑比1s的電子云半徑大,說(shuō)明2s的電子比1s的多 C.s能級(jí)上電子的能量總小于p能級(jí)上電子的能量 D.電子僅在激發(fā)態(tài)躍遷到基態(tài)時(shí)才會(huì)產(chǎn)生原子光譜 組卷:157引用:4難度:0.7 -
6.下列各原子或離子的電子排布中,不正確的是( )
A.N 1s22s22p3 B.Ar 1s22s22p63s23p6 C.Na+1s22s22p6 D.Cl-1s22s22p63s23p5 組卷:172引用:2難度:0.7
二、填空題(本題包括4小題,共55分)
-
 18.氯氨是氯氣遇到氨氣反應(yīng)生成的一類化合物,是常用的飲用水二級(jí)消毒劑,主要包括一氯胺、二氯胺和三氯胺(NH2Cl、NHCl2和NCl3),副產(chǎn)物少于其它水消毒劑。
18.氯氨是氯氣遇到氨氣反應(yīng)生成的一類化合物,是常用的飲用水二級(jí)消毒劑,主要包括一氯胺、二氯胺和三氯胺(NH2Cl、NHCl2和NCl3),副產(chǎn)物少于其它水消毒劑。
回答下列問(wèn)題:
(1)①一氯胺(NH2Cl)的電子式為。
②工業(yè)上可利用反應(yīng)Cl2(g)+NH3(g)═NH2Cl(l)+HCl(g)制備一氯胺,已知部分化學(xué)鍵的鍵能如下表所示(假設(shè)不同物質(zhì)中同種化學(xué)鍵的鏈能相同),則該反應(yīng)的ΔH=。
③一氯胺是重要的水消毒劑,其原因是由于一氯胺在中性、酸性環(huán)境中會(huì)發(fā)生水解,生成具有強(qiáng)烈殺菌作用的物質(zhì),該反應(yīng)的化學(xué)方程式為化學(xué)鍵 N-H Cl-Cl N-Cl H-Cl 鍵能(kJ/mol) 391.3 243.0 191.2 431.8 。
(2)用Cl2和NH3反應(yīng)制備二氯胺的方程式為2Cl2(g)+NH3(g)?NHCl2(l)+2HCl(g),向容積均為1L的甲、乙兩個(gè)恒溫(反應(yīng)溫度分別為400℃、T℃)容器中分別加入2mol Cl2和2mol NH3,測(cè)得各容器中n(Cl2)隨反應(yīng)時(shí)間t的變化情況如下表所示:
①甲容器中,0~40min內(nèi)用NH3的濃度變化表示的平均反應(yīng)速率v(NH3)=t/min 0 40 80 120 160 n(Cl2)(甲容器)/mol 2.00 1.50 1.10 0.80 0.80 n(Cl2)(乙容器)/mol 2.00 1.45 1.00 1.00 1.00 。
②該反應(yīng)的ΔH0(填“>”或“<”),理由是。
③對(duì)該反應(yīng),下列說(shuō)法正確的是(填選項(xiàng)字母)。
A.若容器內(nèi)氣體密度不變,則表明反應(yīng)達(dá)到平衡狀態(tài)
B.若容器內(nèi)Cl2和NH3物質(zhì)的量之比不變,則表明反應(yīng)達(dá)到平衡狀態(tài)
C.反應(yīng)達(dá)到平衡后,其他條件不變,在原容器中充入一定量氦氣,Cl2的轉(zhuǎn)化率增大
D.反應(yīng)達(dá)到平衡后,其他條件不變,加入一定量的NHCl2,平衡向逆反應(yīng)方向移動(dòng)
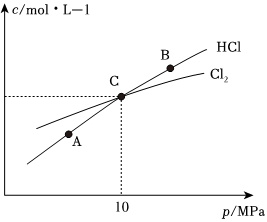
(3)在恒溫條件下,2molCl2和1molNH3發(fā)生反應(yīng)2Cl2(g)+NH3(g)?NHCl2(l)+2HCl(g),測(cè)得平衡時(shí)Cl2和HCl的物質(zhì)的量濃度與平衡總壓的關(guān)系如圖所示:
①A、B、C三點(diǎn)中Cl2轉(zhuǎn)化率最高的是點(diǎn)(填“A”“B”或“C”)。
②計(jì)算C點(diǎn)時(shí)該反應(yīng)的壓強(qiáng)平衡常數(shù)Kp(C)=(Kp是平衡分壓代替平衡濃度計(jì)算,分壓=總壓×物質(zhì)的量分?jǐn)?shù))組卷:234引用:5難度:0.1 -
19.油脂廠廢棄的油脂加氫鎳催化劑主要含金屬Ni、Al、Fe及其氧化物,還有少量其他不溶性物質(zhì)。用如圖工藝流程回收鎳制備硫酸鎳晶體(NiSO4?7H2O):
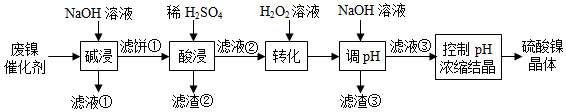
溶液中金屬離子開(kāi)始沉淀和完全沉淀的pH如表所示:
回答下列問(wèn)題:金屬離子 Ni2+ Al3+ Fe3+ Fe2+ 開(kāi)始沉淀時(shí)(c=0.01mol/L)的pH 7.2 3.7 2.2 7.5 沉淀完全時(shí)(c=1.0×10-5mol/L)的pH 8.7 4.7 3.2 9.0
(1)Fe在周期表中的位置為,基態(tài)Fe原子的簡(jiǎn)化電子排布式為。
(2)“濾液②”中含有的金屬離子是。
(3)“轉(zhuǎn)化”中可替代H2O2的物質(zhì)是。
(4)如果“轉(zhuǎn)化”后的溶液中Ni2+濃度為1.0mol/L,則“調(diào)pH”應(yīng)控制的pH范圍是。
(5)硫酸鎳在強(qiáng)堿溶液中用NaClO氧化,可沉淀出能用作鎳鎘電池正極材料的NiOOH。寫(xiě)出該反應(yīng)的離子方程式。
(6)將分離出硫酸鎳晶體后的母液收集、循環(huán)使用,其意義是。組卷:9引用:2難度:0.5


