2021-2022學(xué)年四川省綿陽市高二(上)期末化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題(本題包括14小題,每小題3分,共42分。每小題只有一個選項符合題意)
-
1.X-射線衍射實驗是鑒別晶體與非晶體最可靠的方法,下列屬于晶體的是( )
A.瑪瑙 B.陶瓷 C.水晶 D.玻璃 組卷:18引用:3難度:0.6 -
2.下列分子中屬于非極性分子的是( )
A.H2O B.CH4 C.NH3 D.HCl 組卷:70引用:6難度:0.9 -
3.HNO2常用于有機合成,下列事實無法證明其為弱電解質(zhì)的是( )
A.用稀HNO2溶液做導(dǎo)電實驗時,發(fā)現(xiàn)燈泡很暗 B.等pH、等體積的亞硝酸比鹽酸中和NaOH的物質(zhì)的量多 C.25℃時0.1mol/LHNO2溶液的pH約為3 D.25℃時pH=2的HNO2溶液稀釋至100倍,pH<4 組卷:41引用:3難度:0.5 -
4.下列Li原子電子排布圖表示的狀態(tài)中,能量最高的是( )
A. 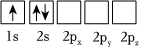
B. 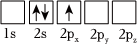
C. 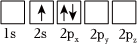
D. 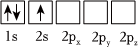 組卷:93引用:9難度:0.7
組卷:93引用:9難度:0.7 -
5.下列相關(guān)比較中,正確的是( )
A.分解溫度:MgCO3>CaCO3>BaCO3 B.熔點:Na>Mg>Al C.微粒半徑:r(Cl-)>r(O2-)>r(Na+) D.熱穩(wěn)定性:H2O>H2S>HCl 組卷:11引用:3難度:0.5 -
6.下列化學(xué)用語使用錯誤的是( )
A.33As的基態(tài)原子核外電子排布簡式:[Ar]4s24p3 B.液氨中存在的氫鍵:N-H???N C.NH4Cl的電子式: 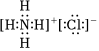
D.NaHSO4水溶液中的電離方程式:NaHSO4=Na++H++ SO2-4組卷:10引用:3難度:0.6
五、(本題包括2小題,共20分)
-
18.按要求回答下列問題:
(1)下列物質(zhì)中屬于強電解質(zhì)的是(填標(biāo)號,下同),屬于非電解質(zhì)的是。
①Cl2②熔融態(tài)的NaCl③氨水④鹽酸溶液⑤乙醇⑥BaSO4⑦H2O⑧HF⑨CO
(2)若T℃時,醋酸的電離常數(shù)K=1.6×10-5,則該溫度下0.01mol/L的醋酸溶液的c(H+)約為mol/L。
(3)若T℃時,pH=2的醋酸溶液中由水電離出的c(H+)=1×10-11mol/L,則該溫度下水的離子積常數(shù)Kw=,將此溫度下VaLpH=1的HCl溶液與VbLpH=11的NaOH溶液混合后pH=3,則=VaVb。組卷:42引用:2難度:0.7 -
19.工業(yè)上常以水煤氣為原料制備氫氣或甲醇,其主要反應(yīng):CO(g)+H2O(g)?CO2(g)+H2(g)ΔH稱為CO催化變換反應(yīng),請回答下列問題。
(1)已知在25℃時:
2C(石墨)+O2(g)=2CO(g)ΔH1=-222kJ/mol
2H2(g)+O2(g)=2H2O(g)ΔH2=-484kJ/mol
C(石墨)+O2(g)=CO2(g)ΔH3=-394kJ/mol
則25℃時,CO催化變換反應(yīng)的ΔH=。
(2)某溫度下CO催化變換反應(yīng)平衡常數(shù)為9,反應(yīng)開始時CO(g)和H2O(g)的濃度都是0.01mol/L,達(dá)平衡時CO的轉(zhuǎn)化率為;在該溫度下,若起始時c(CO)=0.01mol/L,c(H2O)=0.02mol/L,反應(yīng)一段時間后,測得c(H2)=0.005mol/L,則此時該反應(yīng)v正v逆(填“>”“<”或“=”)。
(3)恒溫恒容條件下,判斷CO催化變換反應(yīng)達(dá)到平衡狀態(tài)的標(biāo)志有。
A.容器內(nèi)的壓強保持不變
B.容器中H2O(g)的濃度與CO2的濃度相等
C.容器中混合氣體的密度保持不變
D.CO的生成速率與H2的生成速率相等
E.2molH-O鍵斷裂的同時有1molH-H鍵斷裂
(4)在CO催化變換反應(yīng)的產(chǎn)物中補充氫氣可以用于工業(yè)制備甲醇:3H2(g)+CO2(g)?CH3OH(g)+H2O(g),當(dāng)起始投料=3時,在不同條件下達(dá)到平衡,測得體系中甲醇物質(zhì)的量分?jǐn)?shù)為x(CH3OH),如圖所示,a線表示在t=250℃下的x(CH3OH)~p、b線表示在p=5×105Pa下的x(CH3OH)~t。n(H2)n(CO2)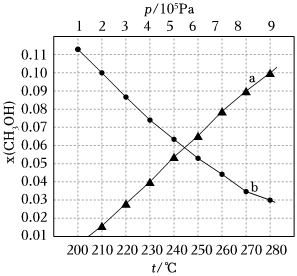
①根據(jù)圖像判斷該制備甲醇反應(yīng)ΔH0。
②已知:氣體分壓(p分)=氣體總壓(p總)×體積分?jǐn)?shù),用某物質(zhì)的平衡分壓代替物質(zhì)的量濃度也可以表示化學(xué)平衡常數(shù)(記作Kp),則250℃時,當(dāng)x(CH3OH)=0.10時,計算該反應(yīng)Kp=(只需列出計算表達(dá)式)。組卷:26引用:1難度:0.6


