2022-2023學(xué)年廣東省廣州市華南師大附中高二(上)期末化學(xué)試卷
發(fā)布:2024/11/29 7:0:2
一、單項選擇題:本大題共16小題,共44分;1-10題每小題3分,11-16題每小題3分。
-
1.下列圖示變化為吸熱反應(yīng)的是( )
A. 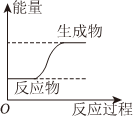
B. 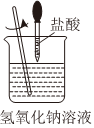
C. 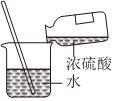
D. 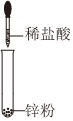 組卷:86引用:11難度:0.8
組卷:86引用:11難度:0.8 -
2.下列物質(zhì)溶解于水時,電離出的陽離子能使水的電離平衡向右移動的是( )
A.NH4Cl B.CH3COONa C.H2SO4 D.KNO3 組卷:42引用:2難度:0.8 -
3.已知在25℃和35℃時,水的離子積分別為K(25℃)=1.0×10-14、K(35℃)=2.1×10-14,則下列敘述中正確的是( )
A.c(H+)隨溫度的升高而降低 B.35℃時純水中c(H+)>c(OH-) C.水的電離度:α(25℃)>α(35℃) D.純水的pH可能小于7 組卷:57引用:2難度:0.8 -
4.下列關(guān)于溶液酸堿性的說法中,正確的是( )
A.c(H+)=10-6mol?L-1的溶液一定顯酸性 B.pH=7的溶液一定顯中性 C.c(OH-)=c(H+)的溶液一定顯中性 D.不能使酚酞試液變紅的溶液一定顯酸性 組卷:54引用:3難度:0.6 -
5.對飽和AgCl溶液(有AgCl固體存在)進行下列操作后,c(Ag+)保持不變的是( )
A.加少量水稀釋 B.加熱 C.加入少量濃鹽酸 D.加入少量固體AgNO3 組卷:49引用:2難度:0.7 -
6.向0.1mol?L-1CH3COOH溶液中加入少量CH3COONa晶體時,會引起的變化是( )
A.溶液的pH增大 B.CH3COOH的電離度變大 C.溶液中c(OH-)減小 D.溶液的導(dǎo)電能力減弱 組卷:34引用:2難度:0.7
二、非選擇題:本大題共4小題,共56分。
-
19.結(jié)合所學(xué)知識,按要求回答問題。
(1)按要求寫出電極反應(yīng)式
①堿性鋅錳電池的總反應(yīng)為Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,寫出正極反應(yīng)式。
②將2FeCl3+2KI=I2+2FeCl2+2KCl設(shè)計成雙液電池:正極燒杯中盛放的溶液為,電池負極的電極反應(yīng)式為。
(2)如圖是以石墨為電極,電解MgCl2溶液的裝置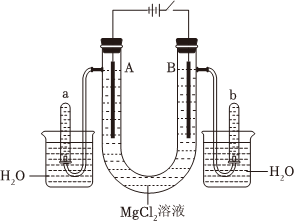
①電解時,A電極發(fā)生的電極反應(yīng)為。
②檢驗b管中氣體的方法是。
(3)某同學(xué)設(shè)計了如圖所示裝置,用氫氧燃料電池作為電源探究粗銅精煉原理,根據(jù)要求回答問題: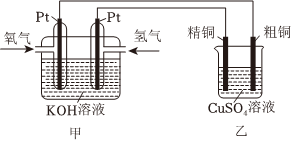
①甲裝置中通入氧氣的電極為(填“正極”或“負極”),氧氣發(fā)生的電極反應(yīng)式。
②如果粗銅中含有鐵、銀等雜質(zhì),粗銅電極發(fā)生的電極反應(yīng)式有。乙裝置中反應(yīng)一段時間后,CuSO4溶液的濃度(填“增大”、“減小”或“不變”)。
③已知NA為阿伏加德羅常數(shù)的值。若在標(biāo)準(zhǔn)狀況下,甲裝置有2.24L氧氣參加反應(yīng),則乙裝置中陰極析出銅的質(zhì)量理論上為g。組卷:120引用:2難度:0.4 -
20.氮是地球上含量豐富的一種元素,氮及其化合物是科學(xué)研究的重點內(nèi)容:在0.5L的密閉容器中,一定量的氮氣和氫氣進行如下化學(xué)反應(yīng):N2(g)+3H2(g)?2NH3(g)ΔH<0,其化學(xué)平衡常數(shù)K與溫度T的關(guān)系如下表:
請回答下列問題:T/℃ 200 300 400 K K1 K2 0.5
(1)試比較K1、K2的大小,K1K2(填“>”、“=”或“<”)。
(2)下列各項能作為判斷該反應(yīng)達到化學(xué)平衡狀態(tài)的依據(jù)是(填序號字母)。
a.容器內(nèi)N2、H2、NH3的濃度之比為1:3:2
b.3v正(N2)=v逆(H2)
c.v正(NH3)=v逆(NH3)
d.混合氣體的密度保持不變
(3)400℃時,反應(yīng)2NH3(g)?N2(g)+3H2(g)的平衡常數(shù)K=。當(dāng)測得NH3、N2、H2的濃度分別為3mol?L-1、2mol?L-1、1mol?L-1時,則該反應(yīng)的v正(N2)v逆(N2)(填“>”、“=”或“<”)。
(4)如圖為一定溫度下,N2和H2以1:3進行反應(yīng),平衡時,NH3的體積分?jǐn)?shù)隨壓強的變化示意圖。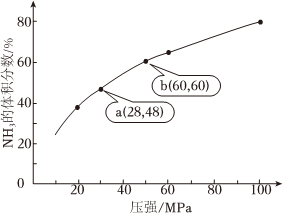
①隨壓強增大,NH3的體積分?jǐn)?shù)增大的原因是。
②比較b點和a點:平衡常數(shù)K(a)K(b)(填“>”、“<”或“=”,下同),N2的濃度c(a)c(b)。
③計算b點的平衡常數(shù)Kp=。組卷:42引用:2難度:0.7


