2020-2021學年四川省綿陽市南山中學高二(下)開學化學試卷
發布:2024/12/11 12:0:2
一、選擇題(本題包括14小題,每小題3分,共42分。每小題只有一個選項符合題意)
-
1.化學與生活、社會發展息息相關,下列說法不正確的是( )
A.“霾塵積聚難見路人”霧霾所形成的氣溶膠有丁達爾效應 B.“熬膽礬鐵釜,久之亦化為銅”,該過程發生了置換反應 C.“水乳交融,火上澆油”兩者都是物理變化 D.古劍“沈盧”“以劑鋼為刃,柔鐵為莖干,不爾則多斷折”,劑鋼指的是鐵的合金 組卷:14引用:2難度:0.7 -
2.有關化學用語正確的是( )
A.氨氣的結構式為 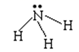
B.乙烯的結構簡式:CH2CH2 C.羥基的電子式: 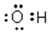
D.甲醇的球棍模型: 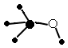 組卷:5引用:1難度:0.4
組卷:5引用:1難度:0.4 -
3.下列圖示裝置能達到實驗目的的是( )
A. 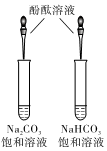
如圖比較CO32-和HCO3-水解能力的強弱B. 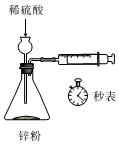
如圖測定鋅與稀硫酸的反應速率C. 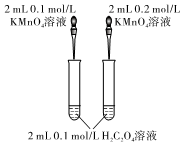
如圖研究濃度對反應速率的影響D. 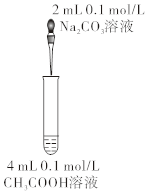
如圖比較碳酸和醋酸的酸性強弱組卷:17引用:5難度:0.5 -
4.鈦號稱“崛起的第三金屬”,因具有密度小、強度大、無磁性等優良的機械性能,被廣泛應用于軍事、醫學等領域.已知鈦有48Ti、49Ti、50Ti等同位素,下列關于金屬鈦的敘述中不正確的是( )
A.上述鈦原子中,中子數不可能為22 B.鈦元素在周期表中處于第四周期ⅡB族 C.鈦原子的外圍電子層排布為3d24s2 D.鈦元素位于元素周期表的d區,是過渡元素 組卷:36引用:12難度:0.7 -
5.下列過程中,化學平衡不發生移動的是( )
A.H2、I2、HI平衡時的混合氣體加壓后顏色變深 B.Na2CrO4溶液中滴加稀硫酸,溶液顏色變深 C.紅棕色的NO2加壓后顏色先變深后逐漸變淺 D.向氯水中加入適量石灰石,氯水的殺菌能力增強 組卷:16引用:2難度:0.7 -
6.室溫時,某溶液中由水電離生成的H+和OH-物質的量濃度的乘積為1×10-24,則在該溶液中一定不能大量共存的離子組是( )
A.Al3+、Na+、NO3-、Cl- B.K+、Na+、Cl-、CO32- C.NH4+、Na+、Cl-、SO42- D.NH4+、K+、SiO32-、NO3- 組卷:38引用:7難度:0.7
四、(本題包括1小題,共10分)
-
18.氯化銅晶體(CuCl2?2H2O)中含有FeCl2雜質,為制得純凈的氯化銅晶體,首先將其制成水溶液,再按如圖所示的操作步驟進行提純。
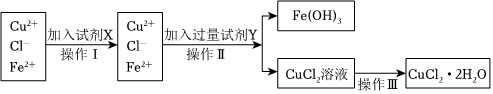
請參照如表給出的數據填空。
(1)操作Ⅰ加入X的目的是氫氧化物開始沉淀時的pH 氫氧化物沉淀完全時的pH Cu2+ 4.7 6.7 Fe2+ 7.0 9.0 Fe3+ 1.9 3.2 。
(2)下列物質都可以作為X,適合本實驗的X物質可以是。(填字母)
A.KMnO4
B.NaClO
C.H2O2
D.K2Cr2O7
(3)操作Ⅱ的Y試劑為(填化學式),并調節溶液的pH在范圍。
(4)實驗室在配制CuCl2溶液時需加入少許(填物質名稱),理由是(文字敘述并用有關離子方程式表示)。
(5)若要得無水CuCl2,請簡述操作方法。組卷:2引用:2難度:0.6
五、(本題包括1小題,共12分)
-
19.砷(As)是第四周期ⅤA族元素,可以形成As2O5、H3AsO3、H3AsO4等化合物,有著廣泛的用途。回答下列問題:
(1)畫出砷的原子結構示意圖:。
(2)已知:As(s)+H2(g)+2O2(g)═H3AsO4(s)△H132
H2(g)+O2(g)═H2O(l)△H212
2As(s)+O2(g)═As2O5(s)△H352
則反應As2O5(s)+3H2O(l)═2H3AsO4(s)的△H=。
(3)H3AsO3和H3AsO4水溶液中含砷的各物種的分布分數(平衡時某物種的濃度占各物種濃度之和的分數)與pH的關系分別如圖1左、右兩圖所示。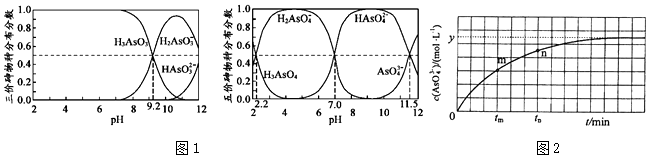
①以酚酞為指示劑(變色范圍pH8.0~10.0),將NaOH溶液逐滴加入到H3AsO3溶液中,當溶液由無色變為淺紅色時停止滴加。該過程中主要反應的離子方程式為。
②H3AsO4第一步電離方程式H3AsO4?H2AsO4-+H+的電離常數為Ka1,則pKa1=。(pKa1=-lgKa1)
(4)298K時,將一定量的Na3AsO3、I2和NaOH溶液混合,發生反應:AsO33-(aq)+I2(aq)+2OH-(aq)?AsO43-(aq)+2I-(aq)+H2O(l)溶液中c(AsO43-)與反應時間t的關系如圖2所示。
①該反應的平衡常數表達式為。
②下列可判斷反應達到平衡的是。(填標號)
a.溶液的pH不再變化
b.v(I-)=2v(AsO33-)
c.不再變化c(AsO3-4)c(AsO3-3)
d.c(I-)=ymol?L-1
③tm時,v正v逆。(填“>”、“<”或“=”)組卷:9引用:1難度:0.4


