2021-2022學年天津市五校聯考高二(上)期末化學試卷
發布:2024/12/10 3:0:1
一、選擇題(每小題只有一個選項符合題意,共13小題,每題3分,共39分)
-
1.化學與社會、生活密切相關。下列說法不正確的是( )
A.鍋爐水垢中含有的CaSO4,可先用Na2CO3溶液處理,后用酸除去 B.含重金屬離子的電鍍廢液不能隨意排放 C.進行胃鏡透視時,不能用碳酸鋇代替硫酸鋇作為鋇餐 D.明礬凈水與自來水的殺菌消毒原理相同 組卷:78引用:1難度:0.8 -
2.下列敘述正確的是( )
A.CH4(g)+2O2(g)═CO2(g)+2H2O(g)ΔH=-846kJ/mol,因此甲烷的燃燒熱ΔH=-846kJ/mol B.常溫下,將pH=4的醋酸溶液加水稀釋,溶液中所有離子的濃度均降低 C.4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)常溫下能自發進行,該反應的ΔH<0 D.在一容積可變的密閉容器中反應2SO2(g)+O2(g)?2SO3(g)達平衡后,保持溫度不變,縮小體積,平衡正向移動, 的值增大c2(SO3)c2(SO2)c(O2)組卷:74引用:5難度:0.7 -
3.下列表達方式正確的是( )
A.As的電子排布式:[Ar]4s24p3 2p B.N的價電子排布圖 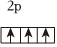
C.Cr原子結構示意圖 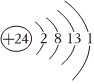
D.Fe2+的價電子排布式為:[Ar]3d54s1 組卷:92引用:4難度:0.6 -
4.下列實驗裝置或操作能達到實驗目的的是( )
A.  驗證鐵的析氫腐蝕
驗證鐵的析氫腐蝕B.  中和滴定
中和滴定C.  滴定管讀數為18.20mL
滴定管讀數為18.20mLD.  為保護鐵閘門采用的陰極保護法為犧牲陽極法組卷:20引用:1難度:0.5
為保護鐵閘門采用的陰極保護法為犧牲陽極法組卷:20引用:1難度:0.5 -
5.下列實驗操作對應的現象與結論均正確的是( )
選項 實驗操作 現象 結論 A 常溫下將Ba(OH)2?8H2O晶體與NH4Cl晶體在小燒杯中混合 燒杯壁變涼 該反應正向是熵增的反應 B 將充有NO2的密閉燒瓶放入熱水中 燒瓶內氣體顏色變深 NO2生成N2O4的反應中,△H>0 C 將0.1mol/L的弱酸HA稀釋成0.01mol/L,測量稀釋前后溶液pH pH增大 稀釋后HA電離程度減小 D 常溫下向物質的量濃度均為0.1mol/L的NaCl和NaI混合溶液中逐滴滴入AgNO3溶液 先出現黃色沉淀 Ksp(AgCl)<Ksp(AgI) A.A B.B C.C D.D 組卷:68引用:3難度:0.7
二、填空題(本題共4小題,共61分)
-
16.請回答下列問題:(25℃時,部分物質的電離平衡常數如表所示)
(1)相同溫度下,等pH的CH3COONa溶液、Na2CO3溶液和Na2SO3溶液,三種溶液的物質的量濃度c(CH3COONa)、c(Na2CO3)、c(Na2SO3)由大到小排序化學式 CH3COOH NH3?H2O H2CO3 H2SO3 電離平衡常數 1.7×10-5 1.7×10-5 K1=4.3×10-7K2=5.6×10-11 K1=1.3×10-2K2=6.3×10-8 .
(2)25℃時,向0.1mol?L-1的氨水中緩緩通入少量CO2氣體的過程中(忽略溶液體積的變化),下列表達式的數值變小的是.
A.0.1-c(NH4+)c(HCO-3)
B.c(H+)c(OH-)
C.c(OH-)c(NH3?H2O)
D.c(H+)?c(NH3?H2O)c(NH4+)
(3)向20mL0.1mol?L-1CH3COOH中滴加0.1mol?L-1NaOH溶液過程中,pH變化如圖.
①A點溶液pH1.(填“>”、“<”或“=”).
②下列說法正確的是.
a.A、C兩點水的電離程度:A>C
b.B點溶液中微粒濃度滿足:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
c.D點溶液微粒濃度滿足:c(Na+)=c(CH3COOH)+c(CH3COO-)
(4)能證明醋酸是弱酸的實驗事實是(填寫序號).
①相同條件下,濃度均為0.1mol?L-1的鹽酸和醋酸,醋酸的導電能力更弱
②25℃時,一定濃度的CH3COOH、CH3COONa混合溶液的pH等于7
③CH3COOH溶液能與NaHCO3反應生成CO2
④0.1mol?L-1CH3COOH溶液可使紫色石蕊試液變紅
(5)在25℃時對氨水進行如下操作,請填寫下列空白
①若向氨水中加入稀硫酸,使氨水恰好被中和,寫出反應的離子方程式;所得溶液的pH7填(填“>”“=”或“<”),用離子方程式表示其原因.
②若向氨水中加入稀硫酸至溶液pH=7,此時溶液中的c(NH4+)=amol/L,則c(SO42-)=.組卷:216引用:2難度:0.6 -
 17.高鐵酸鹽在能源、環保等領域有著廣泛的應用。
17.高鐵酸鹽在能源、環保等領域有著廣泛的應用。
資料:高鐵酸鉀(K2FeO4)固體呈紫色,能溶于水,微溶于濃KOH溶液。K2FeO4在堿性溶液中性質穩定。
(1)研究人員用Ni、Fe作電極電解濃KOH溶液制備K2FeO4,裝置示意圖如圖。
①Ni電極作(填“陰”或“陽”)極。
②Fe電極上的電極反應為。
③循環使用的物質是(填化學式)溶液。
④向陽極流出液中加入飽和KOH溶液,析出紫色固體。試從平衡的角度解釋析出固體的原因:。
(2)K2FeO4可用于處理廢水中的NaCN。用如下方法測定處理后的廢水中NaCN的含量(廢水中不含干擾測定的物質)。
資料:Ag++2CN-═Ag(CN)2-Ag++I-═AgI↓(黃色)CN-優先于I-與Ag+反應。
取amL處理后的廢水于錐形瓶中,滴加幾滴KI溶液作指示劑,再用cmol/L AgNO3溶液滴定,消耗AgNO3溶液的體積為VmL。滴定終點時的現象是,經處理后的廢水中NaCN的含量為g/L。(已知:NaCN的摩爾質量:49g/mol)組卷:97引用:5難度:0.6


