2023年天津市市區重點中學高考化學二模試卷
發布:2024/4/20 14:35:0
一、選擇題(本大題共12小題,共36分)
-
1.化學與社會、生產、生活密切相關。下列說法錯誤的是( )
A.久置的紅薯變甜,是因為葡萄糖發生了水解 B.電熱水器用鎂棒防止金屬內膽腐蝕,原理是犧牲陽極保護法 C.第五形態的碳單質“碳納米泡沫”,與石墨烯互為同素異形體 D.用太陽能光催化分解水代替電解水制氫氣有利于節能環保 組卷:87引用:4難度:0.7 -
2.古代典籍富載化學知識,下述之物見其還原性者為( )
A.石膽(CuSO4?5H2O):“石膽能化鐵為銅。” B.強水(HNO3):“性最烈,能蝕五金,??????” C.礬(FeSO4?7H2O):“蓋此礬色綠味酸,燒之則赤。” D.金箔(Au):“凡金箔,每金七厘造方寸金一千片,??????” 組卷:73引用:3難度:0.8 -
3.作為溝通微觀與宏觀物質世界的重要橋梁,化學是人類認識和改造物質世界的主要方法和手段之一,下列說法一定不正確的是( )
A.乙烯分子中的π鍵: 
B.Se是人體必需的微量元素, Se和7834Se互為同位素8034C.原子結構示意圖  既可以表示16O,也可以表示18O
既可以表示16O,也可以表示18OD.淀粉與纖維素均可用(C6H10O5)n來表示,二者互為同分異構體 組卷:36引用:1難度:0.8 -
4.下列敘述正確的是( )
A.鈉的焰色反應是電子由基態轉化成激發態時釋放能量產生的 B.價電子排布為5s25p1的元素位于第五周期第ⅠA族,屬于s區元素 C.各能層的s電子云輪廓圖都是球形,但球的半徑大小不同 D.乙醇比甲醚的沸點高是因為乙醇的相對分子質量大 組卷:151引用:4難度:0.8 -
5.打開分液漏斗活塞和玻璃塞,進行如圖所示的探究實驗,對實驗現象分析正確的是( )

A.試管中產生大量氣泡,說明Na2SO3被氧化產生SO2 B.試管內CCl4層溶液褪色,說明Br2具有還原性 C.試管中浸有品紅溶液的棉球褪色,說明SO2具有氧化性 D.一段時間后試管內有白色沉淀,說明有 生成SO2-4組卷:181引用:4難度:0.6
二、簡答題(本大題共4小題,共64分)
-
15.甲烷是重要的資源,通過下列過程可實現由甲烷到氫氣的轉化。

(1)500℃時,CH4與H2O重整主要發生下列反應:
CH4(g)+H2O(g)?CO(g)+3H2(g)
CO(g)+H2O(g)?H2(g)+CO2(g)
已知CaO(s)+CO2(g)=CaCO3(s)ΔH=-178.8kJ?mol-1。向重整反應體系中加入適量多孔CaO,其優點是。
(2)CH4與CO2重整的主要反應的熱化學方程式為
反應I:CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH=+246.5kJ?mol-1
反應II:H2(g)+CO2(g)=CO(g)+H2O(g)ΔH=+41.2kJ?mol-1
反應III:2CO(g)=CO2(g)+C(s)ΔH=-172.5kJ?mol-1
①在CH4與CO2重整體系中通入適量H2O(g),可減少C(s)的生成,反應3CH4(g)+CO2(g)+2H2O(g)=4CO(g)+8H2(g)的ΔH=。
②1.01×105Pa下,將n起始(CO2):n起始(CH4)=1:1的混合氣體置于密閉容器中,不同溫度下重整體系中CH4和CO2的平衡轉化率如圖1所示。800℃下CO2平衡轉化率遠大于600℃下CO2平衡轉化率,其原因是。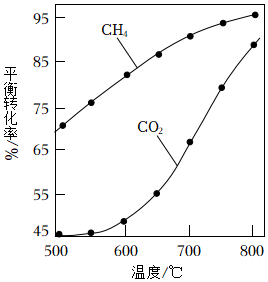
(3)利用銅-鈰氧化物(xCuO?yCeO2,Ce是活潑金屬)催化氧化可除去H2中少量CO,催化氧化過程中Cu、Ce的化合價均發生變化,可能機理如圖2所示。將n(CO):n(O2):n(H2):n(N2)=1:1:49:49的混合氣體以一定流速通過裝有xCuO?yCeO2催化劑的反應器,CO的轉化率隨溫度變化的曲線如圖3所示。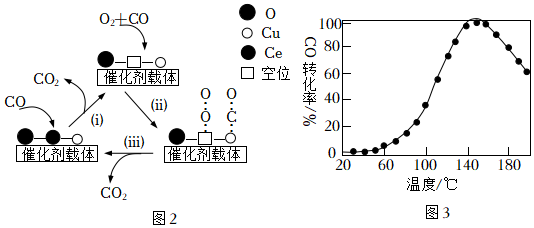
①Ce基態原子核外電子排布式為[Xe]4f15d16s2,圖2所示機理的步驟(i)中,元素Cu、Ce化合價發生的變化為。
②當催化氧化溫度超過150℃時,催化劑的催化活性下降,其可能原因是。組卷:668引用:4難度:0.5 -
16.三氯氧磷POCl3是一種化工原料,可用于制取有機磷農藥,長效磺胺藥物等,還可用作染料中間體、有機合成的氯化劑和催化劑、阻燃劑等。利用O2和PCl3為原料可制備三氯氧磷,其制備裝置如圖所示(夾持裝置略去):

已知PCl3和三氯氧磷的性質如表:
回答下列問題:熔點/℃ 沸點/℃ 其它物理或化學性質 PCl3 -112.0 76.0 PCl3和POCl3互溶,均為無色液體,遇水均劇烈水解,發生復分解反應生成磷的含氧酸和HCl POCl3 1.25 106.0
(1)儀器乙的名稱是,其作用為。
(2)裝置B的作用是(寫兩點)。
(3)裝置C中發生反應的化學方程式,用溫度計控制溫度在60~65℃之間,溫度不宜過高也不宜過低的原因是。
(4)通過佛爾哈德法可以測定三氯氧磷產品中Cl元素含量,實驗步驟如下:
Ⅰ.取ag產品于錐形瓶中,加入足量NaOH溶液待完全水解后加稀硝酸至溶液呈酸性。
Ⅱ.向錐形瓶中加入0.1000mol?L-1的AgNO3溶液20.00mL,使Cl-完全沉淀。
Ⅲ.向其中加入2mL硝基苯,用力搖動,使沉淀表面被有機物覆蓋。
Ⅳ.加入指示劑,用cmol?L-1NH4SCN溶液滴定過量Ag+至終點,記錄所用體積為VmL。
已知:Ksp(AgCl)=1.77×10-10,Ksp(AgSCN)=1.03×10-12。
①滴定選用的指示劑是(填字母)。
a.FeCl2
b.NH4Fe(SO4)2
c.淀粉
d.甲基橙
②實驗過程中加入硝基苯的目的是;達到滴定終點的判斷方法是。
③若無硝基苯覆蓋沉淀表面,測定POCl3的質量分數將(填“偏大”“偏小”或“無影響”)。
④所測Cl元素含量為(列出表達式)。組卷:71引用:2難度:0.6


