2022-2023學(xué)年吉林省吉林市高二(上)期中化學(xué)試卷
發(fā)布:2024/6/7 8:0:9
一、選擇題(15道題,每小題只有一個(gè)選項(xiàng)符合題目要求,每題3分,共45分)
-
1.化學(xué)與生產(chǎn)、生活密切相關(guān)。下列說法錯(cuò)誤的是( )
A.牙膏中添加氟化物能起到預(yù)防齲齒的作用 B.草木灰與銨態(tài)氮肥不能混合施用 C.聚合硫酸鐵[Fe2(OH)x(SO4)y]n是一種新型絮凝劑,可用于殺菌消毒 D.將SOCl2與AlCl6?6H2O混合并加熱,可得到無水氯化鋁 組卷:3引用:2難度:0.7 -
2.合成氨工業(yè)采用循環(huán)操作,主要為了( )
A.降低氨的沸點(diǎn) B.增大化學(xué)反應(yīng)速率 C.提高氮?dú)夂蜌錃獾睦寐?/label> D.提高平衡混合物中氨的含量 組卷:158引用:10難度:0.9 -
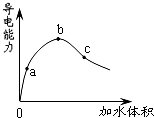 3.在一定溫度下,冰醋酸加水稀釋過程中,溶液的導(dǎo)電能力如圖所示.下列說法不正確的是( )
3.在一定溫度下,冰醋酸加水稀釋過程中,溶液的導(dǎo)電能力如圖所示.下列說法不正確的是( )A.在0點(diǎn)時(shí),醋酸不導(dǎo)電 B.a(chǎn)、b、c三點(diǎn),a點(diǎn)時(shí)醋酸溶液中H+濃度最小 C.b點(diǎn)時(shí),醋酸電離程度最大 D.可通過微熱的方法使c點(diǎn)溶液中c(CH3COO-)增大 組卷:169引用:12難度:0.9 -
4.在密閉容器里,A與B反應(yīng)生成C,其反應(yīng)速率分別用vA、vB、vC表示,已知2vB=3vA、3vC=2vB,則此反應(yīng)可表示為( )
A.2A+3B=2C B.A+3B=2C C.3A+B=2C D.A+B=C 組卷:1095引用:127難度:0.9 -
5.已知強(qiáng)酸與強(qiáng)堿的稀溶液發(fā)生中和反應(yīng)的熱化學(xué)方程式為H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1,向0.1L 0.2mol?L-1的NaOH溶液中加入下列物質(zhì):①稀醋酸;②濃硫酸;③稀鹽酸,恰好完全反應(yīng)。則其焓變△H1、△H2、△H3的關(guān)系是( )
A.△H1>△H2>△H3 B.△H1>△H3>△H2 C.△H1=△H3>△H2 D.△H1<△H3<△H2 組卷:163引用:5難度:0.5 -
6.為了除去MgCl2酸性溶液中的Fe3+,可在加熱攪拌的條件下加入一種試劑過濾后,再加入適量的鹽酸,這種試劑是( )
A.NH3?H2O B.NaOH C.Na2CO3 D.MgCO3 組卷:516引用:117難度:0.9
二、非選擇題(4道題,共55分)
-
 18.C1化學(xué)又稱一碳化學(xué),研究以含有一個(gè)碳原子的物質(zhì)為原料合成工業(yè)產(chǎn)品的有機(jī)化學(xué)及工藝,因其在材料科學(xué)和開發(fā)清潔燃料方面的重要作用已發(fā)展成為一門學(xué)科。燃煤廢氣中的CO、CO2均能轉(zhuǎn)化為基礎(chǔ)化工原料、清潔能源甲醇。一定條件下,在恒壓密閉容器中投入9molCO和15molH2,催化劑作用下充分反應(yīng),CH3OH在平衡混合氣中的體積分?jǐn)?shù)在不同壓強(qiáng)下隨溫度的變化如圖所示:
18.C1化學(xué)又稱一碳化學(xué),研究以含有一個(gè)碳原子的物質(zhì)為原料合成工業(yè)產(chǎn)品的有機(jī)化學(xué)及工藝,因其在材料科學(xué)和開發(fā)清潔燃料方面的重要作用已發(fā)展成為一門學(xué)科。燃煤廢氣中的CO、CO2均能轉(zhuǎn)化為基礎(chǔ)化工原料、清潔能源甲醇。一定條件下,在恒壓密閉容器中投入9molCO和15molH2,催化劑作用下充分反應(yīng),CH3OH在平衡混合氣中的體積分?jǐn)?shù)在不同壓強(qiáng)下隨溫度的變化如圖所示:
(1)該反應(yīng)的平衡常數(shù)為K═則化學(xué)方程式為c(CH3OH)[c(CO)c2(H2)],該反應(yīng)的ΔH0,ΔS0(填“>”“=”或“<”)。
(2)P1、P2、P3由大到小的順序?yàn)?,計(jì)算A點(diǎn)的壓強(qiáng)平衡常數(shù)Kp═(用平衡分壓代替平衡濃度計(jì)算,分壓=總壓×體積分?jǐn)?shù))。
(3)300℃,P2條件下,處于E點(diǎn)時(shí)反應(yīng)的方向是(填“正反應(yīng)”“逆反應(yīng)”或“平衡狀態(tài)”)。
(4)某溫度下,能說明該反應(yīng)已經(jīng)達(dá)到平衡狀態(tài)的是(填序號(hào))。
A.容器內(nèi)各組分濃度相等
B.速率之比v(CO):v(H2):v(CH3OH)=1:2:1
C.H2的消耗速率等于CH3OH的消耗速率
D.容器內(nèi)混合氣體的平均相對(duì)分子質(zhì)量不再變化
E.容器內(nèi)的密度不再變化組卷:12引用:2難度:0.5 -
19.亞砷酸(H3AsO3)可用于治療白血病,亞砷酸在溶液中存在多種微粒形態(tài),各種微粒的物質(zhì)的量分?jǐn)?shù)與溶液pH的關(guān)系如圖所示。

(1)人體血液的pH為7.35~7.45,用藥后人體所含砷元素的主要微粒是。
(2)將KOH溶液逐滴滴入H3AsO3溶液中,當(dāng)pH由11變化到12過程中,所發(fā)生反應(yīng)的離子方程式是。
(3)H3AsO3第一步電離的方程式為,電離常數(shù)為Ka1,則pKa1=(pKa1=-lgKa1);已知碳酸的電離常數(shù)Ka1=4.5×10-7、Ka2=4.7×10-11,將少量K2CO3溶液加入H3AsO3溶液中,寫出反應(yīng)的離子方程式。
(4)下列說法中正確的是(填序號(hào))。
A.pH=12時(shí),c(H2)+2c(AsO-3)+3c(HAsO2-3)+c(OH-)=c(H+)AsO3-3
B.pH=14時(shí),c()>c(AsO3-3)>c(H2HAsO2-3)>c(OH-)AsO-3
C.Na2HAsO3溶液中,c()>c(H2HAsO2-3)>c(AsO-3)AsO3-3
(5)工業(yè)含砷(Ⅲ)廢水常用鐵鹽處理后排放。其原理是:鐵鹽混凝劑在溶液中產(chǎn)生Fe(OH)3膠粒,其表面帶有正電荷,可吸附含砷化合物。通過實(shí)驗(yàn)測(cè)得不同pH條件下鐵鹽對(duì)含砷(Ⅲ)化合物的去除率,如圖所示pH為5~9時(shí),隨溶液pH的增大,鐵鹽混凝劑對(duì)含砷(Ⅲ)化合物的吸附效果增強(qiáng)。結(jié)合本題圖示,解釋可能的原因。【注】砷(Ⅲ)代表化合價(jià)為+3價(jià)的砷元素。
①;
②。組卷:3引用:2難度:0.5


