2020-2021學年江蘇省泰州市高二(下)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題共39分單項選擇題:本題包括13小題,每小題3分,共計39分。每小題只有一個選項最符合題意。
-
1.化學與人類生活、醫療技術、環境保護、工業生產密不可分。下列說法正確的是( )
A.普通食醋中含有3%~5%的乙酸 B.乙醛溶液又稱福爾馬林,具有防腐性能 C.廢棄鉛蓄電池須作深埋處理 D.食品包裝袋的主要成分是聚氯乙烯 組卷:6引用:1難度:0.7 -
2.過度運動之后肌肉酸痛是乳酸[CH3CH(OH)COOH]堆積造成的,可通過持續有氧運動促使乳酸加速代謝形成CO2和H2O排出而消除。下列有關敘述正確的是( )
A.14C的中子數為6 B.羥基的電子式為 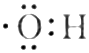
C.基態O原子的價電子排布圖為 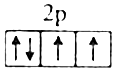
D.水分子的球棍模型為  組卷:9引用:1難度:0.7
組卷:9引用:1難度:0.7 -
3.實驗室制取少量溴苯并提純的過程中不能達到實驗目的的是( )
A B C D 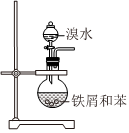
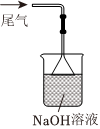
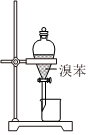
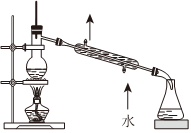
制備溴苯 吸收尾氣 水洗后分液 分餾獲得溴苯 A.A B.B C.C D.D 組卷:7引用:2難度:0.5 -
4.營養化學是一門新興的化學分支。下列有關說法正確的是( )
A.食用油和石蠟油都屬于烴類 B.蔗糖能發生水解反應和銀鏡反應 C.雞蛋清中加入濃硝酸,加熱能夠發生顏色反應 D.氨基酸屬于天然高分子化合物 組卷:12引用:3難度:0.8 -
5.某烴的結構如圖所示。下列有關說法正確的是( )
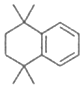
A.該烴的分子式為C12H22 B.該烴常溫下呈氣態,難溶于水 C.該烴的一氯代物有5種 D.該烴與H2充分加成后的產物中含有2個手性碳原子 組卷:5引用:1難度:0.7
二、非選擇題共61分
-
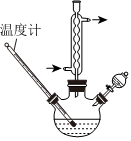 16.環己酮是重要的化工原料和化工溶劑,某研究小組對其進行了一些探究。
16.環己酮是重要的化工原料和化工溶劑,某研究小組對其進行了一些探究。
Ⅰ.環己酮的制備。
反應原理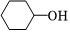 Na2Cr2O7/H+55~60℃
Na2Cr2O7/H+55~60℃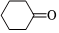 ,還原產物為Cr2(SO4)3,反應過程放熱,溫度過高時環己酮易進一步被氧化,實驗裝置如圖所示。
,還原產物為Cr2(SO4)3,反應過程放熱,溫度過高時環己酮易進一步被氧化,實驗裝置如圖所示。
已知:Na2Cr2O7溶液呈橙紅色,Cr2(SO4)3溶液呈墨綠色。
(1)分液漏斗中盛放的試劑為。(填字母)
a.Na2Cr2O7溶液
b.環己醇的硫酸溶液
(2)三頸燒瓶中反應體系的溫度需控制在55~60℃,其加熱方式為。
(3)反應結束后,還需滴加甲醇,直到(填實驗現象)為止,隨后分離提純得到環己酮。
(4)若20.0 mL環己醇(ρ=0.96g?cm-3)完全反應并提純后,得到純環己酮(ρ=0.94g?cm-3)9.6mL,則環己酮的產率為。(計算結果保留2位有效數字)
Ⅱ.環己酮的結構與性質
(5)環己酮中三種元素的電負性由小到大的順序為。(用元素符號表示)
(6)若要測定環己酮的相對分子質量,可以采用的波譜分析手段為。
(7)已知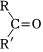 R“OHH+
R“OHH+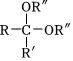 。環己酮和乙二醇在酸性條件下反應生成分子式為C8H14O2的產物,其結構簡式為 。組卷:14引用:2難度:0.4
。環己酮和乙二醇在酸性條件下反應生成分子式為C8H14O2的產物,其結構簡式為 。組卷:14引用:2難度:0.4 -
17.鈷在材料、化工等領域應用廣泛。可用廢舊鋰電池預處理得到的活性物質LiCoO2(不溶于水)為原料回收金屬鈷或制備草酸鈷(CoC2O4)。已知:在溶液中Co2+可與NH3?H2O、C2O42-形成配離子[Co(NH3)6]2+、
[Co(C2O4)3]4-。
(1)用30%過氧化氫、1mol?L-1硫酸混合溶液對活性物質進行浸出,浸出時LiCoO2生成Co2+,則反應的離子方程式為。
(2)用鋅棒作陽極、石墨作陰極電解浸出液,將Co2+還原為Co單質以回收金屬鈷。若其他條件相同,測得pH約為4時Co2+的殘留率最低,其可能原因是。
(3)向浸出液中加入草酸銨[(NH4)2C2O4]溶液可制得CoC2O4。其他條件相同時,溶液pH、對鈷沉淀率的影響如圖1、圖2所示c(C2O2-4)c(Co2+)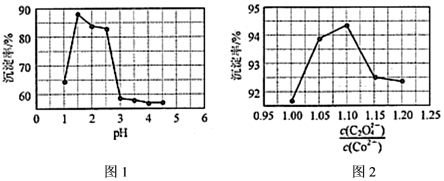
①“沉鈷”時采取的最適宜的pH分別為c(C2O2-4)c(Co2+)、。
②pH>2.5時,鈷沉淀率變化的可能原因是。
(4)Co與CO、H2在一定條件下可制得HCo(CO)4。HCo(CO)4與R-CH=CH2可反應生成高碳醛,反應歷程如圖3所示,則由R-CH=CH2生成高碳醛總的化學反應方程式可表示為。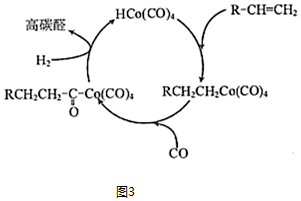 組卷:9引用:1難度:0.6
組卷:9引用:1難度:0.6


