2020-2021學年江蘇省泰州市高三(上)期末化學試卷
發布:2024/11/29 6:30:2
一、選擇題(共7小題,每小題2分,滿分12分)
-
1.化學與生活、生產密切相關,下列敘述錯誤的是( )
A.用CO2合成可降解的聚碳酸酯塑料,能減少“白色污染” B.催化處理汽車尾氣,能減輕氮氧化物污染 C.減少使用氟氯代烷作制冷劑,能保護臭氧層 D.禁止使用任何食品添加劑,以防對人體健康有害 組卷:22引用:1難度:0.6 -
2.下列有關物質的性質與用途具有對應關系的是( )
A.ClO2具有氧化性,可用于自來水的殺菌消毒 B.某些油脂常溫時呈固態,可用于制作肥皂 C.濃硫酸具有脫水性,可用于干燥氯氣 D.高純硅硬度大,可用做半導體材料 組卷:10引用:1難度:0.7 -
3.下列選項所示的物質間轉化均能實現的是( )
A.NaCl(aq) NaHCO3(s)CO2(g)Na2CO3(s)加熱B.MnO2(s) Cl2(g)稀鹽酸漂白粉石灰水C.Cu(s) NO2(g)濃硝酸HNO3(aq)H2O(l)D.CH3CH2Br CH3CH2OHNaOH/乙醇C2H4濃硫酸170℃組卷:13引用:1難度:0.6 -
4.氨硼烷(NH3BH3)的結構和乙烷相似,下列關于NH3BH3的敘述正確的是( )
A.電負性大小順序:B>N>H B.分子中所有原子共平面 C.分子中N-B鍵是配位鍵,其電子對由N提供 D.氨硼烷為共價晶體,具有很高的熔點 組卷:88引用:2難度:0.7 -
5.下列制取SO2、驗證其性質的裝置不能達到實驗目的的是( )
A. 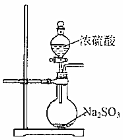 制取SO2
制取SO2B. 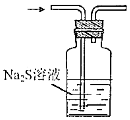 驗證其氧化性
驗證其氧化性C. 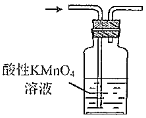 驗證其還原性
驗證其還原性D. 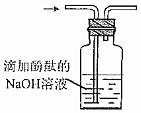 驗證其漂白性組卷:17引用:2難度:0.5
驗證其漂白性組卷:17引用:2難度:0.5
三、解答題(共4小題,滿分64分)
-
16.鐵的硫化物被認為是有前景的鋰電池材料,但導電性較差,放電時易膨脹。
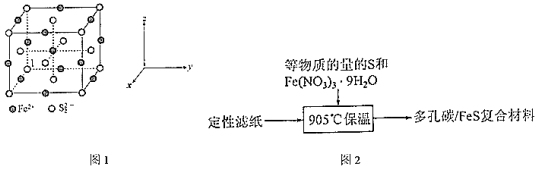
(1)Li-FeS2電池是綜合性能較好的一種電池。
①水熱法合成FeS2納米顆粒的方法是將等物質的量的FeSO4、S、Na2S2O3研磨置于反應釜中,加入蒸餾水加熱使之恰好反應,該反應的化學方程式為。
②FeS2晶體的晶胞結構示意圖如圖1所示,離子1的分數坐標是(0,0,0),則離子1最近的Fe2+分數坐標為(任寫一個),每個Fe2+周圍距離最近且相等的有S2-2個。
(2)①將FeS鑲嵌在多孔碳中制成多孔碳/FeS復合材料,該電極材料相較FeS具有的優勢是放電時不易膨脹且,多孔碳/FeS復合材料制取方法如圖2,定性濾紙的作用是提供碳源和。
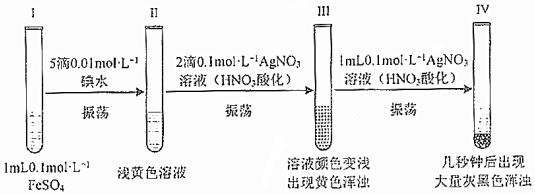
②分別取多孔碳、多孔碳/FeS電極在氧氣中加熱,測得固體殘留率隨溫度變化情況如圖3所示,多孔碳/FeS最終轉化為Fe2O3,固體殘留率為50%。(固體殘留率=×100%)固體樣品的剩余質量固體樣品的起始質量
420℃~569℃時,多孔碳/FeS固體殘留率增大的原因是。
③FeS作為鋰電池正極材料,放電時先后發生如下反應:2FeS+2Li++2e-═Li2FeS2+Fe;Li2FeS2+2Li++2e-═2Li2S+Fe。該多孔碳/FeS電極質量為4.8g,該電極理論上最多可以得電子mol。(寫出計算過程)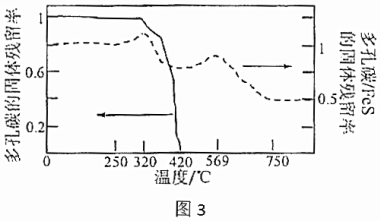 組卷:6引用:1難度:0.6
組卷:6引用:1難度:0.6 -
17.某興趣小組欲探究反應2Fe2++I2?2Fe3++2I-,設計如圖實驗:
(1)Ⅰ、Ⅱ均未檢驗出Fe3+,檢驗有無Fe3+的試劑是。
(2)經檢驗,Ⅱ→Ⅲ的過程中產生了Fe3+.對Fe3+產生的原因作出如下假設:
假設a:Fe2+被空氣氧化,離子方程式為。
假設b:Fe2+“被酸性溶液中NO3-氧化;
假設c:Fe2+被I2氧化。
小組同學通過進一步實驗證實了a、b不是產生Fe的主要原因,又查閱資料得知I2+2Fe2+?2Fe3++2I-的反應限度小、產生的c(Fe3+)低,故推測c(Fe3+)增大是因為向Ⅱ的淺黃色溶液中加入AgNO3溶液后,,促使該平衡正向移動。
(3)上述推測雖然合理,但Ⅳ中灰黑色渾濁中只檢驗出少量AgI,主要成分是Ag。小組同學查閱資料得知新制的AgI見光分解速率較慢,故又對Ⅱ→Ⅲ過程中產生Fe3+的原因提出了假設d:,該反應的離子方程式為,并設計實驗證明該假設合理,實驗方案為。
(4)經測定,Ⅲ→Ⅳ的過程中溫度幾乎無變化,c(Ag+)隨反應時間的變化如圖所示。若在實驗開始時,先向Ⅲ的溶液中加入幾滴Fe2(SO4)3溶液,c(Ag+)隨反應時間的變化與題圖相同,則Ⅳ中迅速出現灰黑色渾濁的原因可能是。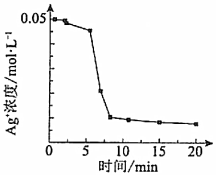 組卷:33引用:1難度:0.6
組卷:33引用:1難度:0.6


