2022-2023學年山東省實驗中學高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本題包括10小題,每小題2分,共20分。每小題只有一個選項符合題意)
-
1.化學與生產生活密切相關,下列說法正確的是( )
A.泡沫滅火器的成分是蘇打和硫酸鋁溶液 B.采用催化轉換技術能提高汽車尾氣中有害氣體的平衡轉化率 C.神舟十三號飛船的太陽能電池和儲能電池均可將化學能轉化為電能 D.漂白粉和明礬都常用于自來水的處理,二者的作用原理是不相同的 組卷:17引用:1難度:0.7 -
2.下列說法中不正確的是( )
A.葡萄糖分子(HOCH2-CHOH-CHOH-CHOH-CHOH-CHO)中的手性碳原子數為4 B.CH4、CCl4都是含有極性鍵的非極性分子 C. 與C2-2互為等電子體,1O2+2中含有的π鍵數目為2NAmolO2+2D.AB2是V形,其A為sp3雜化 組卷:89引用:1難度:0.8 -
3.下列表示正確的是( )
A.中子數為176的某核素: Ts176117B.基態鋅原子的價層電子排布式:3d104s2 C.26Fe3+的結構示意圖: 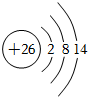
D.基態氮原子的軌道表示式: 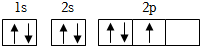 組卷:469引用:10難度:0.5
組卷:469引用:10難度:0.5 -
4.下列裝置或操作能達到實驗目的的是( )
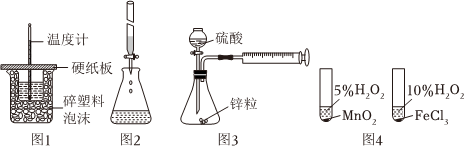
A.圖1裝置用于硫酸和Ba(OH)2反應的中和熱測定 B.圖2裝置用于酸性高錳酸鉀溶液滴定草酸 C.圖3裝置用于測定H+表示的反應速率(單位mL/s) D.圖4裝置用于研究不同催化劑對反應速率的影響 組卷:13引用:1難度:0.6 -
5.表中實驗操作、現象與結論對應關系均正確的( )
選項 實驗操作 實驗現象 結論 A 等體積pH═2的兩種酸HX和HY分別與足量的鋅反應 HX溶液中放出的H2多 HX的酸性比HY強 B 向濃度均為0.1mol/L的NaCl和NaI的混合溶液中滴加少量0.1mol/L的AgNO3溶液 產生黃色沉淀 Ksp(AgCl)>Ksp(AgI) C 在KSCN與FeCl3的混合液中再加入KCl固體 溶液顏色變淺 增大生成物濃度,平衡逆向移動 D 用廣泛pH試紙測定1mol/LNaHSO3溶液的酸堿性 測定pH═3.2 NaHSO3溶液呈酸性,證明HSO3-在水中的電離程度大于水解程度 A.A B.B C.C D.D 組卷:42引用:3難度:0.5 -
6.現有四種元素的基態原子的電子排布式如下:①1s22s22p63s23p4②1s22s22p63s23p3③1s22s22p3④1s22s22p5。則下列有關比較中正確的是( )
A.第一電離能:④>③>②>① B.原子半徑:④>③>②>① C.電負性:④>③>②>① D.最高正化合價:④>③=②>① 組卷:560引用:184難度:0.7 -
7.常溫下,某一元強酸HX溶液與某一元強堿MOH溶液按2:5的體積比混合后,測得溶液中c(M+)=c(X-)。則混合前,該強酸的pH與強堿的pH之和約為( )(已知:不考慮溶液混合時體積和溫度的變化,lg2≈0.3)
A.13.3 B.13.6 C.13.9 D.14.2 組卷:69引用:3難度:0.5
三、填空題(本題包括5個小題,共60分)
-
21.碳酸鍶(SrCO3)難溶于水,主要用于電磁材料和金屬冶煉。一種由工業碳酸鍶(含少量Ba2+、Ca2+、Mg2+、Pb2+等)制備高純碳酸鍶的工藝流程如圖:

已知:Ⅰ.Cr(OH)3為兩性氫氧化物;
Ⅱ.常溫下,各物質的溶度積常數如表所示。
(1)“除鋇、鉛”時,pH過低會導致(NH4)2CrO4的利用率降低,原因為化合物 Cr(OH)3 Ca(OH)2 Mg(OH)2 SrCO3 Ksp近似值 1×10-31 5.5×10-6 1.8×10-11 5.6×10-10 (用離子方程式解釋)。
(2)“濾渣2”的主要成分為(填化學式)。
(3)用氨水和NaOH分步調節pH,而不是直接調節溶液的pH≈13的原因為。
(4)“調pH≈13”后需對溶液進行煮沸并趁熱過濾出濾渣2,煮沸并趁熱過濾的原因為。
(5)已知:碳酸的電離常數Ka1=4.0×10-7、Ka2=4.0×10-11,則“碳化”時,反應Sr2(aq)+2(aq)?SrCO3(s)+H2CO3(aq)的平衡常數K=HCO-3(保留兩位有效數字)。
(6)“系列操作”中包含“200℃烘干”操作,烘干過程中除蒸發水分外,還能夠除去SrCO3中的微量可溶性雜質,該雜質除NH4HCO3外還可能為(填化學式)。組卷:47引用:1難度:0.6 -
22.溫室氣體讓地球發燒,倡導低碳生活,是一種可持續發展的環保責任,將CO2應用于生產中實現其綜合利用是目前的研究熱點。
Ⅰ.(1)在催化作用下由CO2和CH4轉化為CH3COOH,一定溫度下,在恒容密閉容器中按1:1充入CO2和CH4,發生反應CO2(g)+CH4(g)?CH3COOH(g),下列各項能判斷該反應已經達到平衡狀態的是。
A.混合氣體的密度不變
B.CO2的體積分數保持不變
C.v(CO2)=v(CH4)
D.混合氣體的平均摩爾質量不變
Ⅱ.研究證明,CO2可作為合成低碳烯烴的原料,目前利用CO2與H2合成乙烯相關的熱化學方程式如下:
反應ⅰ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.01kJ?mol-1
反應ⅱ:2CH3OH(g)=C2H4(g)+2H2O(g) ΔH2=-29.98kJ?mol-1
(2)由CO2制C2H4的熱化學方程式。
(3)一定條件下,CO2(g)+3H2(g)=CH3OH(g)+H2O(g)的反應歷程如圖所示: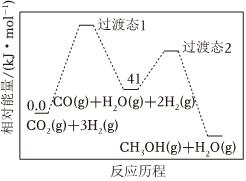
該反應的反應速率由第(“1”或“2”)步決定。
Ⅲ.在三個容積均為1L的密閉容器中以不同的氫碳比[]充入H2和CO2,在一定條件下發生反應:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g),CO2的平衡轉化率隨溫度的變化如圖所示。n(H2)n(CO2)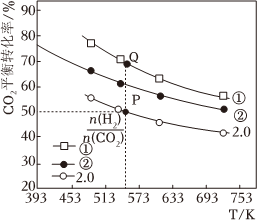
(4)CO2的平衡轉化率隨溫度的升高而降低,其原因是,氫碳比①②(填“>”“<”或“=”)。
(5)若起始充入0.5molCO2、1.0molH2,計算Q點的平衡常數K=。
Ⅳ.一種新型短路膜電化學電池可以消除,裝置如圖所示: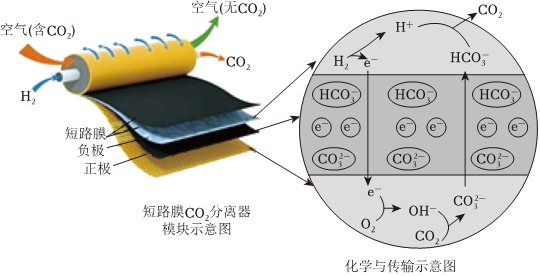
(6)該裝置可用于空氣中CO2的捕獲,緩解溫室效應,由裝置示意圖可知,向極移動,負極的電極反應式是。組卷:25引用:3難度:0.6


