2020-2021學年湖南省常德一中高一(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題(共20小題,每小題2.5分,滿分50.0分)
-
1.“節能減排,保護環境”已經深入人心,下列舉措與這一主題不吻合的是( )
A.用“綠色化學”工藝,使原料完全轉化為產物 B.推廣燃煤脫硫技術,防治SO2污染 C.推廣垃圾的分類存放、回收、處理 D.大量使用農藥化肥提高糧食產量 組卷:41引用:5難度:0.9 -
2.
N是常用于醫學PET顯像的一種核素,這里的“13”是指該原子的( )137A.質子數 B.電子數 C.中子數 D.質量數 組卷:90引用:6難度:0.9 -
3.下列實驗操作均要用玻璃棒,其中玻璃棒的作用及其目的相同的是( )
①過濾 ②蒸發 ③溶解 ④向容量瓶轉移液體。A.①和② B.①和③ C.③和④ D.①和④ 組卷:1326引用:417難度:0.9 -
4.配制一定體積、一定物質的量濃度的溶液時,下列操作會使配得的溶液濃度偏小的是( )
A.容量瓶中原有少量蒸餾水 B.溶液從燒杯轉移到容量瓶中后沒有洗滌燒杯 C.定容時觀察液面俯視 D.滴管加水時,有少量水滴到容量瓶外 組卷:100引用:22難度:0.9 -
5.下列變化中需要加入還原劑才能實現的是( )
A.SO2→SO42- B.H2→H2O C.CO2→CO D.Cl2→Cl- 組卷:39引用:3難度:0.7 -
6.元素X、Y的原子在化學反應中都易失2個電子而形成穩定結構,若X原子半徑小于Y原子的半徑,則下列說法中正確的是( )
A.金屬性:X>Y B.它們可能是非金屬元素 C.兩種原子都有相同的電子層數 D.堿性:Y(OH)2大于X(OH)2 組卷:53引用:2難度:0.8 -
7.用NA代表阿伏加德羅常數,相關說法不正確的是( )
A.13.5 g Al與足量鹽酸反應生成H2的分子數為NA B.標準狀況下,2.24 L CH4所含電子數為NA C.500 mL 1 mol?L-1的K2SO4溶液中含有K+數目為NA D.0.5 mol O2和0.5 mol O3的混合物所含有的氧原子個數為2.5NA 組卷:18引用:5難度:0.7 -
8.下列變化過程中化學鍵被破壞的是( )
A.液態水加熱變成水蒸氣 B.酒精溶于水形成酒精水溶液 C.固態碘加熱升華 D.HBr氣體溶于水形成氫溴酸溶液 組卷:36引用:1難度:0.8
二、填空題(共5小題,每小題10分,滿分50分)
-
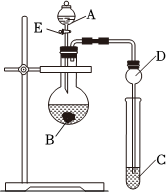 24.某研究性學習小組設計了一組實驗來探究元素周期律.甲同學根據元素非金屬性與對應最高價含氧酸之間的關系,設計了如圖裝置來一次性完成N、C、Si的非金屬性強弱比較的實驗研究;乙同學根據置換反應的規律,利用下圖裝置完成了O元素的非金屬性比S強的實驗研究.回答下列問題:
24.某研究性學習小組設計了一組實驗來探究元素周期律.甲同學根據元素非金屬性與對應最高價含氧酸之間的關系,設計了如圖裝置來一次性完成N、C、Si的非金屬性強弱比較的實驗研究;乙同學根據置換反應的規律,利用下圖裝置完成了O元素的非金屬性比S強的實驗研究.回答下列問題:
(1)圖中D裝置名稱是.
(2)N、C、Si的非金屬性由強到弱的順序是:;從以下所給物質中選出甲同學設計的實驗所用到物質:試劑A為;試劑C為(填序號).
①稀HNO3溶液 ②稀鹽酸 ③碳酸鈣 ④Na2SiO3溶液 ⑤SiO2
(3)①乙同學設計的實驗所用到試劑A為;試劑B為;試劑C為.(寫名稱)
②寫出C中發生反應的化學方程式.組卷:62引用:7難度:0.3 -
25.工業上冶煉冰銅(mCu2O?nFeS)可得到粗銅,在空氣中煅燒冰銅時,產生一種有刺激性氣味的氣體A,該氣體排放到空氣中,會對空氣形成嚴重污染。完成下列填空:
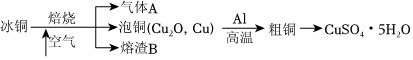
(1)為了降低污染氣體A的排放,可選用下列試劑中的(填序號)吸收。
a.濃硫酸
b.濃硝酸
c.氫氧化鈉溶液
d.石灰乳
(2)已知Al能將某些金屬從其氧化物中置換出來,將鋁與泡銅高溫反應可制得粗銅,制取該粗銅的化學方程式是。當轉移電子數為6NA時,理論上消耗Al的質量為g。
(3)SO2氣體和H2S氣體反應可生成單質硫,現有SO2和H2S混合氣體2.0mol,當所得到的氧化產物比還原產物多16克時,則混合氣體中H2S的物質的量可能為:。
(4)納米氧化鋁在陶瓷材料、電子工業、生物醫藥等方面有廣闊的應用前景,它可通過硫酸鋁銨晶體熱分解得到。取4.53g硫酸鋁銨晶體【Al2(NH4)2(SO4)n?24H2O,相對分子質量為906】加熱分解,最終剩余0.51g Al2O3固體。加熱過程中,固體質量隨時間的變化如圖所示。試通過計算確定400℃剩余固體成分的化學式。(寫出計算過程)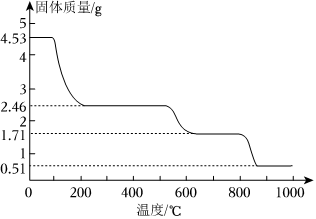 組卷:22引用:1難度:0.6
組卷:22引用:1難度:0.6


