2021-2022學年廣東省汕頭市潮陽區高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題:本題共16小題,共44分,1-10題每小題2分,共20分,11-16題每小題2分,共24分。每小題只有一個選項符合題目要求。
-
1.對文物的研究與保護,能讓我們領略五千年文化的傳承。如表文物修復和保護過程涉及化學變化的是( )
A B C D 



復原三星堆黃金面具 用明礬對古銅鏡除銹復原 古玉器鉆孔連綴 古書畫揭心剝離 A.A B.B C.C D.D 組卷:2引用:1難度:0.7 -
2.日常生活中的下列現象,其物質變化過程中化學反應速率最快的是( )
A.鋼鐵的生銹腐蝕 B.豆漿腐敗變酸 C.黑火藥開山炸石 D.活性炭吸附異味 組卷:22引用:1難度:0.8 -
3.從微觀角度能更好的理解物質的性質,下列有關化學用語表述正確的是( )
A.P的原子結構示意圖為 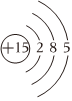
B.中子數為22的氬原子符號為 Ar2218C.乙醇的空間充填模型: 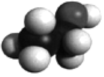
D.由Na和Cl形成離子鍵的過程: 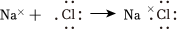 組卷:16引用:2難度:0.6
組卷:16引用:2難度:0.6 -
4.練江治理初見成效,下列有關練江流域的治理方法中沒有涉及化學變化的是( )
A.利用微生物降解水中的有毒有害物質 B.印染企業的廢水經過污水廠處理后,達標排放 C.定期清理淤泥,疏通河道 D.將河道中的垃圾回收分類后,進行無害化處理 組卷:3引用:1難度:0.7 -
5.將CO2轉化為燃料甲醇是實現碳中和的途徑之一、在恒溫恒容密閉容器中進行反應:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)ΔH,下列有關說法正確的是( )
A.若升高溫度,反應逆向進行,則ΔH<0 B.正反應為熵增過程,ΔS>0 C.若混合氣體的密度不隨時間變化,可說明反應達到平衡 D.加入催化劑,可提高CO2的平衡轉化率 組卷:20引用:5難度:0.5 -
6.化學品在生產、生活中應用廣泛,下列應用不涉及氧化還原反應的是( )
A.用氫氟酸刻蝕石英制作藝術品 B.用鋁熱反應焊接鋼軌 C.用氨氣為原料生產硝酸 D.用糯米發酵釀造食醋 組卷:3引用:1難度:0.7
三、非選擇題:本題共4小題,共56分。
-
19.高鐵酸鉀(K2FeO4)是一種高效、多功能新型綠色消毒劑,主要用于飲水處理和化工生產。某化學小組利用如圖裝置和藥品制備K2FeO4并測定純度。回答下列問題:
已知:K2FeO4為紫色固體,具有強氧化性,易溶于水、微溶于濃堿溶液、不溶于乙醇,在0~5℃的強堿性溶液中較穩定。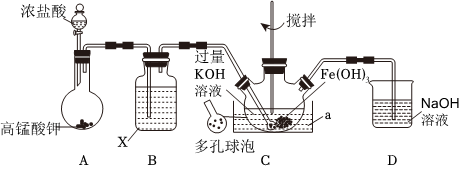
(1)A中發生的化學方程式為。
(2)試劑X的名稱為。
(3)C中采用多孔球泡的目的是。D的作用是。
(4)C中試劑a應選用(填“熱水”或“冰水”)。
(5)K2FeO4粗產品中含有Fe(OH)3、KCl等雜質,若要檢驗KCl的存在,可加入試劑為(填試劑名稱)。
(6)稱取K2FeO4產品0.2000g于燒杯中,加入足量的強堿性亞鉻酸鹽溶液,反應后再加過量稀硫酸使溶液呈強酸性,配成250mL溶液,取出25.00mL注入錐形瓶,用0.01000mol?L-1的(NH4)2Fe(SO4)2溶液滴定至終點,重復操作2次,平均消耗標準溶液27.00mL,則K2FeO4產品的純度為%。[已知:Cr(OH)4-+═Fe(OH)3↓+FeO2-4+OH-,2CrO2-4+2H+═Cr2CrO2-4+H2O,Cr2O2-7+6Fe2++14H+═6Fe3++2Cr3++7H2O]O2-7組卷:8引用:3難度:0.6 -
20.H2S可用于合成熒光粉、光導體等。在石油化工、天然氣開采等行業產生的廢水廢氣中含有較多的H2S,脫除廢水廢氣中的H2S對環境保護、資源再利用有著現實意義。回答下列問題:
Ⅰ.在活性炭催化作用下脫除煤氣中的H2S(g),將其轉化為H2(g)和S(s)。
(1)已知H2(g)的燃燒熱為285.8kJ?mol-1,S(s)的燃燒熱為296.6kJ?mol-1,2H2S(g)+3O2(g)═2H2O(l)+2SO2(g)ΔH1=-1125.2kJ?mol-1。則反應H2S(g)═H2(g)+S(s)ΔH=kJ?mol-1。
(2)T℃時,將3molH2S氣體充入體積為2L的恒容密閉容器中,發生反應H2S(g)?H2(g)+S(g),10min后反應達到平衡,測得容器中混合氣體的總壓強為pkPa,此時混合氣體中H2和H2S的物質的量之比為2:1。
①H2S的轉化率為(保留3位有效數字);
②該溫度下,反應的平衡常數Kp=kPa。(Kp為以分壓表示的平衡常數,分壓=總壓×體積分數)
Ⅱ.天然氣開采過程產生的廢水中主要含有H2S,可用Na2SO3氧化處理。
(3)常溫下,向濃度為0.68g?L-1的H2S溶液中加入一定量Na2SO3固體,在不同pH下的H2S去除率隨時間變化如圖1所示。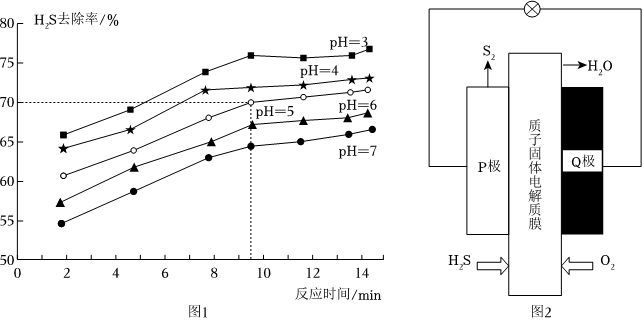
①實際生產中采取pH=5的去除條件,而不選擇更低pH的原因是;
②pH=5時,前10minH2S的去除速率ν(H2S)=mol?L-1?min-1;實際生產中反應時間選擇10min而不是更長,其原因是。
Ⅲ.設計H2S燃料電池,實現回收利用H2S并得到單質硫,其結構示意圖如圖2所示:
(4)①Q極為電池的極(填“負”或“正”)。
②P極發生的電極反應式為。組卷:8引用:1難度:0.5


