2020-2021學年福建省福州市格致中學高二(上)期末化學試卷
發布:2025/1/6 5:0:2
一.選擇題(每一小題只有一個選項符合題意,每一小題3分,共48分)
-
1.未來新能源的特點是資源豐富,在使用時對環境無污染或污染很小,且可以再生.下列屬于未來新能源標準的是( )
①天然氣 ②太陽能 ③風能 ④石油 ⑤煤 ⑥生物質能 ⑦核能 ⑧氫能.A.①②③④ B.②③⑥⑧ C.①②⑤⑥⑦⑧ D.③④⑤⑥⑦⑧ 組卷:211引用:11難度:0.9 -
2.下列鹽溶液因水解呈酸性的是( )
A.CH3COONH4 B.NaHCO3 C.NaHSO3 D.CuSO4 組卷:11引用:2難度:0.8 -
3.下列裝置電流表發生偏轉的是( )
A. 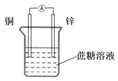
B. 
C. 
D.  組卷:19引用:1難度:0.6
組卷:19引用:1難度:0.6 -
4.硫代硫酸鈉溶液與稀硫酸反應的化學方程式為:Na2S2O3+H2SO4═Na2SO4+SO2+S↓+H2O,下列各組實驗中最先出現渾濁的是( )
實驗 反應溫度/℃ Na2S2O3溶液 稀H2SO4 V/mL c/mol?L-1 V/mL c/mol?L-1 A 25 5 0.1 10 0.1 B 25 5 0.2 10 0.2 C 35 5 0.1 10 0.1 D 35 5 0.2 10 0.2 A.A B.B C.C D.D 組卷:22引用:8難度:0.5 -
5.在恒容密閉容器中,CO和H2S混合加熱生成羰基硫的反應為CO(g)+H2S(g)?COS(g)+H2(g)。下列說法能充分說明該反應已經達到化學平衡狀態的是( )
A.正、逆反應速率都等于零 B.CO、H2S、COS、H2的濃度相等 C.CO、H2S、COS、H2的物質的量分數均不再變化 D.CO、H2S、COS、H2在容器中共存 組卷:28引用:5難度:0.7 -
6.已知:Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=7.7×10-13,Ksp(AgI)=1.5×10-16,則下列難溶鹽的飽和溶液中,Ag+濃度大小順序正確的是( )
A.AgCl>AgBr>AgI B.AgCl>AgI>AgBr C.AgBr>AgCl>AgI D.AgBr>AgI>AgCl 組卷:130引用:2難度:0.9
二.第Ⅱ卷主觀題(共52分)
-
18.研究CO2與CH4反應使之轉化為CO和H2,對減緩燃料危機和減少溫室效應具有重要的意義,工業上CO2與CH4發生反應Ⅰ:CH4(g)+CO2(g)═2CO(g)+2H2(g)△H1。
在反應過程中還發生反應Ⅱ:CO2(g)+H2(g)═CO(g)+H2O(g)△H2=+41kJ/mol。
(1)已知部分化學鍵的鍵能數據如表所示:
則△H1=共價鍵 C-H H-H C=O 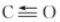
鍵能/kJ/mol 413 436 803 1076 kJ/mol。反應Ⅰ在一定條件下能夠自發進行的原因是,該反應工業生產適宜的溫度和壓強為(填標號)。
A.高溫高壓
B.高溫低壓
C.低溫高壓
D.低溫低壓
(2)工業上將CH4與CO2按物質的量1:1投料制取CO和H2時,CH4和CO2的平衡轉化率隨溫度變化關系如圖所示。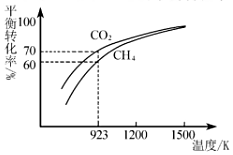
①923K時CO2的平衡轉化率大于CH4的原因是。
②計算923K時反應Ⅱ的化學平衡常數K=(計算結果保留小數點后兩位)。
③1200K以上CO2和CH4的平衡轉化率趨于相等的原因可能是。
(3)工業上CH4和CO2反應時通常會摻入O2發生反應Ⅲ:CH4+2O2═CO2+2H2O,摻入O2,可消除反應產
生的積碳和減小反應器的熱負荷(單位時間內維持反應發生所需供給的熱量),O2的進氣量與反應的熱負
荷的關系如圖所示。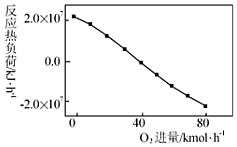
①隨著O2進入量的增加,熱負荷下降的原因是。
②摻入O2可使CH4的平衡轉化率(填“增大”、“減小”或“不變”。下同)。CO2的平衡轉化率。組卷:68引用:5難度:0.5 -
19.電解質的水溶液中存在電離平衡。
Ⅰ.(1)醋酸是常見的弱酸。下列方法中,可以使醋酸稀溶液中CH3COOH電離程度增大的是(填字母序號)。
a.滴加少量濃鹽酸
b.微熱溶液
c.加水稀釋
d.加入少量醋酸鈉晶體
Ⅱ.白醋是常見的烹調酸味輔料,白醋總酸度測定方法如下。
a.量取20.00 mL白醋樣品,用100 mL容量瓶配制成待測液。
b.將滴定管洗凈、潤洗,裝入溶液,趕出尖嘴處氣泡,調整液面至0刻度線。
c.取20.00 mL配制的待測液于潔凈的錐形瓶中,加3滴酚酞溶液,用0.1000 mol?L-1的NaOH溶液滴定至終點,記錄數據。
d.重復滴定實驗3次并記錄數據。
e.計算白醋樣品中醋酸總酸度。回答下列問題:
(2)實驗a中量取20.00 mL白醋所用的儀器名稱是。
(3)若實驗b中堿式滴定管未用NaOH標準溶液潤洗,會造成測定結果比準確值(填“偏大”、“偏小”或“不變”)。
(4)實驗C中判斷滴定終點的現象是。
(5)實驗數據如下表,則該白醋樣品中醋酸總酸度為mol?L-1。
Ⅲ.25℃,醋酸的Ka=1.0×10-4.75。向20.00mL0.1000mol?L-1CH3COOH中滴加0.1000mol?L-1NaOH過程中,pH變化如圖示。待測液體積/mL 標準NaOH溶液 滴定前讀數/mL 滴定終點讀數/mL 第1次 20.00 0 21.98 第2次 20.00 0 22.00 第3次 20.00 0 22.02 
(6)B點溶液pH=。
(7)C點溶液:=c(CH3COOH)c(CH3COO-)。
(8)C點溶液中離子濃度的大小順序:。
(9)A、B、C、D四點中水的電離程度最大的是。組卷:6引用:1難度:0.5


