2021-2022學年河南省焦作市溫縣一中高二(下)開學化學試卷
發布:2024/5/18 8:0:8
一、選擇題:本題共16小題,每小題3分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.我國提出爭取在2030年前實現碳達峰,2060年前實現碳中和。“碳中和”是指CO2的排放總量和減少總量相當。下列措施中能切實可行地促進碳中和的是( )
A.研發催化劑將CO2還原為甲醇 B.不再使用化石燃料,改用薪柴 C.通過清潔煤技術減少煤燃燒產生的污染 D.通過將來源廣泛的水電解獲得氫氣,從而推廣使用氫燃料電池 組卷:4引用:1難度:0.6 -
2.設NA為阿伏加德羅常數的值,下列有關敘述正確的是( )
A.1L0.1mol?L-1Na2SO3溶液中陰離子數目為0.1NA B.1.6gCH4含有共價鍵的數目為0.4NA C.64gCu分別與足量稀硝酸反應時,轉移電子數為NA D.2molSO3充入密閉容器中分解所得產物分子的數目為3NA 組卷:0引用:2難度:0.5 -
3.將適量NaHCO3粉末投入飽和氯水中,能增加溶液中HClO的濃度,其反應原理為NaHCO3+Cl2=NaCl+CO2↑+HClO。下列化學用語表示正確的是( )
A.CO2的電子式: 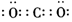
B.HClO的結構式:H-Cl-O C.NaHCO3的電離方程式:NaHCO3?Na++H++CO32- D.NaHCO3溶液顯堿性:HCO3-+H2O?H3O++CO32- 組卷:11引用:4難度:0.4 -
4.下列離子方程式不正確的是( )
A.向FeBr2溶液中通入過量的Cl2:2Fe2++4Br?+3Cl2═2Fe3++2Br2+6Cl- B.泡沫滅火器的滅火原理:Al3++3HCO3?═Al(OH)3↓+3CO2↑ C.用FeCl3飽和溶液制備Fe(OH)3膠體:Fe3++3H2O(沸水) Fe(OH)3(膠體)+3H+△D.用銅電極電解硫酸銅溶液:2Cu2++2H2O 2Cu↓+O2↑+4H+電解組卷:6引用:2難度:0.7 -
5.W、X、Y、Z是四種原子序數依次增大的短周期主族元素,W的單質是密度最小的非金屬單質;X的單質是空氣中含量第二位的物質;Y和Z同周期,其化合物為離子化合物且水溶液呈中性,下列說法錯誤的是( )
A.原子半徑:W<X<Z<Y B.制備Y和Z的單質均可用電解法 C.W與X或者Y形成的化合物中,W的化合價相同 D.X和Y形成的化合物中,X和Y均達到了8e-穩定結構 組卷:2引用:3難度:0.5 -
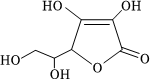 6.維生素C,又稱維他命C,是一種多羥基化合物,其結構如圖,下列關于維生素C的說法錯誤的是( )
6.維生素C,又稱維他命C,是一種多羥基化合物,其結構如圖,下列關于維生素C的說法錯誤的是( )A.不能與氫氧化鈉反應 B.能使溴水褪色 C.能與乙酸反應 D.分子式為C6H8O6 組卷:11引用:5難度:0.7
二、填空題(共52分)
-
 19.一氧化碳和氫氣是重要的化工原料,可以用于合成甲醇、二甲醚、甲酸甲酯等。
19.一氧化碳和氫氣是重要的化工原料,可以用于合成甲醇、二甲醚、甲酸甲酯等。
Ⅰ.(1)已知CO(g)、CH3OH(l)、CH3COOH(l)的燃燒熱分別是ΔH(CO)=-283.2kJ/mol、ΔH(CH3OH)=-723.6kJ/mol和ΔH(CH3COOH)=-870.3kJ/mol,則通常狀況下甲醇與一氧化碳催化合成乙酸的熱化學方程式是:。
Ⅱ.(2)有人設想將CO按下列反應除去:2CO(g)═2C(s)+O2(g)ΔH>0,請你分析該設想能否實現?(填“是”或“否”),依據是。
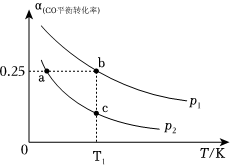
(3)在體積可變的密閉容器中投入2mol CO和2mol H2,在不同條件下發生反應:CO(g)+2H2(g)?CH3OH(g)ΔH。實驗測得平衡時CO的平衡轉化率隨溫度、壓強的變化如圖所示。
①該可逆反應的ΔH0(填“>”、“<”或“=”)。a、b、c三點對應的平衡常數Ka、Kb、Kc的大小關系是。
②若在恒溫恒容條件下進行上述反應,能表示該可逆反應達到平衡狀態的是。(填字母)
A.CO的體積分數保持不變
B.容器內混合氣體的密度保持不變
C.容器內混合氣體的平均摩爾質量保持不變
D.單位時間內消耗CO的濃度等于生成CH3OH的濃度
③若該可逆反應是在T1溫度下進行,達到平衡時容器體積2L,則T1溫度條件下的平衡常數K=。(保留三位小數)
Ⅲ.(4)一定條件下,CO可與粉末狀氫氧化鈉作用生成甲酸鈉。已知常溫時,甲酸的電離平衡常數Ka=1.70×10-4。向20mL 0.1mol/L的甲酸鈉溶液中滴加10mL 0.1mol/L的鹽酸,混合液呈性(填“酸”或“堿”),溶液中離子濃度從大到小的順序為。組卷:12引用:4難度:0.7 -
20.銨鹽是比較重要的鹽類物質,請回答下列問題。
(1)草酸是二元弱酸,能形成兩種銨鹽。
①(NH4)2C2O4溶液呈酸性,溶液中各離子濃度由大到小的順序為。
②NH4HC2O4溶液中,c(H2C2O4)-c(C2)=O2-4。
(2)NH4SCN溶液與AgNO3溶液反應會生成AgSCN沉淀。已知:常溫下,Ksp(AgCl)=1.8×10-10,Ksp(AgSCN)=2.0×10-12,則AgCl轉化為AgSCN的平衡常數K=。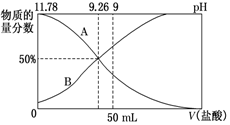
(3)氯化銨是最常見的銨鹽,在工業生產中用途廣泛。
①熱的濃氯化銨溶液可以清洗鐵器表面銹跡,寫出相關反應的離子方程式:。
②常溫下,向100mL0.2mol?L-1的氨水中逐滴加入0.2mol?L-1的鹽酸,所得溶液的pH、溶液中和NH3?H2O的物質的量分數與加入鹽酸的體積的關系如圖所示。NH+4
a.表示NH3?H2O物質的量分數變化的曲線是(填“A”或“B”)。
b.NH3?H2O的電離常數為。
③常溫下,在20mLamol?L-1氨水中滴加20mLbmol?L-1鹽酸恰好使溶液呈中性。常溫下,的水解常數Kh=NH+4(用含a、b的代數式表示)。組卷:8引用:1難度:0.5


