2022-2023學年湖北省武漢市東湖中學高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題:本題共15個小題,每小題3分,共45分.(在每小題給出的四個選項中,只有一項符合題目要求.)
-
1.已知室溫時,0.1mol/L某一元酸HA在水中有0.1%發生電離,下列敘述錯誤的是( )
A.該溶液的pH=4 B.升高溫度,溶液的pH增大 C.此酸的電離平衡常數約為1×10-7 D.由HA電離出的c(H+)約為水電離出的c(H+)的106倍 組卷:480引用:56難度:0.7 -
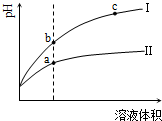 2.某溫度下,相同pH值的鹽酸和醋酸溶液分別加水稀釋,平衡pH值隨溶液體積變化的曲線如圖所示.據圖判斷正確的是( )
2.某溫度下,相同pH值的鹽酸和醋酸溶液分別加水稀釋,平衡pH值隨溶液體積變化的曲線如圖所示.據圖判斷正確的是( )A.Ⅱ為鹽酸稀釋時的pH值變化曲線 B.b點溶液的導電性比c點溶液的導電性強 C.a點Kw的數值比c點Kw的數值大 D.b點酸的總濃度大于a點酸的總濃度 組卷:2012引用:109難度:0.7 -
 3.向某體積固定的密閉容器中加入0.15mol/L的A、0.05mol/L的C和一定量的B三種氣體,一定條件下發生反應,各物質濃度隨時間變化如圖所示。已知在反應過程中混合氣體的平均摩爾質量沒有變化。下列說法錯誤的是( )
3.向某體積固定的密閉容器中加入0.15mol/L的A、0.05mol/L的C和一定量的B三種氣體,一定條件下發生反應,各物質濃度隨時間變化如圖所示。已知在反應過程中混合氣體的平均摩爾質量沒有變化。下列說法錯誤的是( )A.若t1=15,則0~t1內反應速率v(C)=0.004mol/(L?s) B.平衡時A的轉化率為60% C.反應的化學方程式3A(g)?2C(g)+B(g) D.起始B的濃度為0.01mol/L 組卷:34引用:3難度:0.7 -
4.某化學研究小組在探究外界條件對mA(g)+nB(g)?pC(g)的速率和平衡的影響時,畫出了如下圖象。下列判斷正確的是( )
A. 
由圖1可知,T1<T2,化學平衡常數K(T1)>K(T2)B. 
由圖2可知,溫度T1時的反應速率一定大于溫度T2時的反應速率C. 
圖3中,表示反應正向移動的是點1D. 
圖4中,若m+n=p,則a曲線一定使用了催化劑組卷:35引用:4難度:0.6 -
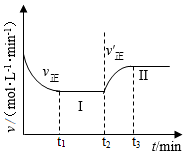 5.已知:A(s)+2B(g)?3C(g),向一恒溫恒容的密閉容器中充入1molA和3molB發生反應,t1時達到平衡狀態Ⅰ,在t2時改變某一條件,t3時重新達到平衡狀態Ⅱ,正反應速率隨時間的變化如圖所示。下列說法不正確的是( )
5.已知:A(s)+2B(g)?3C(g),向一恒溫恒容的密閉容器中充入1molA和3molB發生反應,t1時達到平衡狀態Ⅰ,在t2時改變某一條件,t3時重新達到平衡狀態Ⅱ,正反應速率隨時間的變化如圖所示。下列說法不正確的是( )A.容器內氣體平均相對分子質量不變,表明反應達到平衡 B.t2時可能改變的條件是:向容器中加入C C.平衡常數K:KI═KII D.平衡時B的體積分數φ:φ(Ⅱ)<φ(Ⅰ) 組卷:18引用:3難度:0.5 -
6.下列說法正確的是( )
A.25℃時,NH4Cl溶液的KW大于100℃時NH4Cl溶液的KW B.25℃時,向10mL pH=3的醋酸溶液中加入水稀釋后,溶液中 不變c(CH3COO-)c(CH3COOOH)?c(OH-)C.25℃時,pH=12的氨水和pH=2的鹽酸溶液等體積混合,c(Cl-)>c(NH4+)>c(H+)>c(OH-) D.100℃時,將pH=2的鹽酸與pH=12的NaOH溶液等體積混合,溶液顯中性 組卷:41引用:3難度:0.7
二、非選擇題(本題共4小題,共55分)
-
18.常溫下,部分酸的電離常數如表所示
(1)c(H+)相同的三種酸,其酸的濃度從大到小順序為化學式 HF HCN H2CO3 電離常數 Ka=3.5×10-4 Ka=3.6×10-10 Ka1=4.3×10-7,Ka2=5.6×10-11 。
(2)若HCN的起始濃度為0.1mol?L-1,平衡時c(H+)約為mol?L-1。若使此溶液中HCN的電離程度增大且c(H+)也增大的方法是。
(3)中和等量的NaOH,消耗等pH的氫氟酸和硫酸的體積分別為aL、bL,則a(填“大于”“小于”或“等于”,下同)b。
(4)向NaCN溶液中通入少量的CO2,發生反應的離子方程式為。
(5)25℃時,體積為10mL、pH=2的醋酸溶液與一元酸HX分別加水稀釋至1000mL,稀釋過程pH變化如圖,則HX的電離平衡常數(填“大于”“小于”或“等于”,下同)醋酸的電離平衡常數,稀釋后,HX溶液中水電離出來的c(H+)醋酸溶液中水電離出來的c(H+)。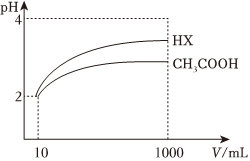 組卷:75引用:7難度:0.7
組卷:75引用:7難度:0.7 -
 19.在1L恒容密閉容器中充入一定量CH3OH發生反應:2CH3OH(g)?CH3OCH3(g)+H2O(g)ΔH,測得CH3OH的濃度與溫度的關系如圖所示:
19.在1L恒容密閉容器中充入一定量CH3OH發生反應:2CH3OH(g)?CH3OCH3(g)+H2O(g)ΔH,測得CH3OH的濃度與溫度的關系如圖所示:
(1)ΔH0(填“>”“<”或“═”),說明理由。
(2)在T1時達到平衡后,再向容器中充入少量甲醇蒸氣,CH3OH的平衡轉化率(填“增大”“減小”或“不變”)。
(3)工業上,利用水煤氣合成CH3OH的反應表示如下:2H2(g)+CO(g)?CH3OH(g)ΔH═-91.0kJ?mol-1,向1L的恒容密閉容器中加入0.1molH2和0.05molCO在一定溫度下發生上述反應,10min后反應達到平衡狀態,測得放出的熱量為3.64kJ。
①從反應開始恰好平衡狀態時,H2的平均反應速率v(H2)為。
②在溫度不變條件下,上述反應達到平衡后再向容器中充入0.01molH2和0.05molCH3OH(g)時,平衡(填“向左移動”、“向右移動”或“不移動”)。組卷:3引用:1難度:0.6


