2020-2021學年四川省南充高級中學高二(下)第一次月考化學試卷
發布:2024/11/8 1:30:2
一、選擇題:本大題共7小題,每小題6分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.化學與生產、生活密切相關,下列敘述錯誤的是( )
A.不銹鋼是一種主要含Fe、Cr、Ni且不易生銹的合金鋼 B.醫用酒精和含氯消毒液殺滅流行性病毒的原理不同 C.開山使用的炸藥“TNT”屬于有機高分子化合物 D.在陽光照射下,利用水和二氧化碳合成的甲醇屬于可再生燃料 組卷:2引用:1難度:0.7 -
2.NA為阿伏加德羅常數的值。下列說法正確的是( )
A.23gC2H6O含C-H鍵數目一定為2.5NA B.用電解法進行粗銅的精煉,當電路中通過的電子數為NA時,陽極一定有32gCu轉化為Cu2+ C.1mol金剛石中含有2NA個C-C鍵,1molSiO2含有4NA個Si-O鍵 D.在密閉容器中將2molSO2和1molO2混合反應后,體系中的原子數小于8NA 組卷:13引用:1難度:0.5 -
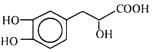 3.丹參素能明顯抑制血小板的聚集,其結構如圖所示,下列說法正確的是( )
3.丹參素能明顯抑制血小板的聚集,其結構如圖所示,下列說法正確的是( )A.丹參素在C原子上取代H的一氯代物有4種 B.在Ni催化下1mol丹參素最多可與4molH2加成 C.1mol丹參素在一定條件下與足量金屬鈉反應可生成4molH2 D.丹參素能發生取代、加成、氧化等反應 組卷:4引用:1難度:0.5 -
4.下列說法不正確的是( )
A.  的σ鍵和π鍵個數比為4:1
的σ鍵和π鍵個數比為4:1B.某元素氣態基態原子的逐級電離能(kJ?mol-1)分別為738、1451、7733、10540、13630、17995、21703,當它與氯氣反應時可能生成的陽離子是X2+ C.Na、P、Cl的電負性依次增大 D.CH3CH(OH)COOH分子中有手性碳原子 組卷:37引用:3難度:0.5
二、解答題(共4小題,滿分43分)
-
 11.NO2、NO、CO等是常見大氣污染物,研究NO2、NO、CO等污染物的處理對建設美麗中國具有重要的意義。
11.NO2、NO、CO等是常見大氣污染物,研究NO2、NO、CO等污染物的處理對建設美麗中國具有重要的意義。
(1)已知:①NO2(g)+CO(g)?CO2(g)+NO(g),斷開1mol下列物質的所有化學鍵時所消耗能量分別為:
②NO2 CO CO2 NO 812kJ 1076kJ 1490kJ 632kJ N2(g)+12O2(g)?NO(g)△H=+89.75kJ?mol-112
③2NO(g)+O2(g)?2NO2(g)△H=-112.3kJ?mol-1
寫出NO與CO反應生成無污染氣體的熱化學方程式:。
(2)污染性氣體NO2與CO在一定條件下的反應為2NO2(g)+4CO(g)?4CO2(g)+N2(g),某溫度下,在1L密閉容器中充入0.1molNO2和0.2molCO,此時容器的壓強為1atm,5s時反應達到平衡,容器的壓強變為原來的,則反應開始到平衡時CO的平均反應速率為v(CO)=2930;若此溫度下,某時刻測得NO2、CO、CO2、N2的濃度分別為amol?L-1、0.4mol?L-1、0.1mol?L-1、1mol?L-1,要使反應向逆反應方向進行,a的取值范圍為。
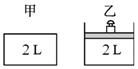
(3)CO和H2在一定條件下可以合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H<0。現在向體積為2L的恒容密閉容器(如圖甲所示)中通入1molCO和2molH2,測定不同時刻、不同溫度(T/℃)下容器中CO的物質的量如表:
請回答:溫度 不同時刻容器中CO的物質的量 0min 10min 20min 30min 40min T1 1mol 0.8mol 0.62mol 0.4mol 0.4mol T2 1mol 0.7mol 0.5mol a a
①T1(填“>”或“<”或“=”)T2,理由是。已知T2℃時,第20min時容器內壓強不再改變,此時H2的轉化率為,該溫度下的化學平衡常數為。
②若將1molCO和2molH2通入原體積為2L的恒壓密閉容器(如圖乙所示)中,達平衡后再向容器中通入1molCH3OH(g),重新達到平衡后,CH3OH(g)在體系中的百分含量。(填“變大”、“變小”或“不變”)。組卷:17引用:1難度:0.3
[化學-選修3:物質結構與性質](共1小題,滿分15分)
-
12.艾姆斯實驗室已制造出包含鈣、鉀、鐵和砷以及少量鎳的CaK(Fe1-xNix)4As4新型化合物材料。
回答下列問題:
(1)基態鎳原子的外圍電子排布式為。
(2)在稀氨水介質中,Ni2+與丁二酮肟(分子式為C4H8N2O2)反應可生成鮮紅色沉淀,其分子結構如圖1所示,該結構中碳原子的雜化方式為;其中碳、氮、氧三種元素第一電離能由大到小的順序為(用元素符號表示)。
(3)鐵、鎳易與CO作用形成羰基配合物Fe(CO)5、Ni(CO)4;1.5mol Fe(CO)5分子中含有σ鍵數目為;已知Ni(CO)4分子為正四面體構型,下列溶劑能夠溶解Ni(CO)4的是(填字母)。
a.四氯化碳 b.苯 c.水 d.液氨
(4)K3AsO3可用于碘的微量分析,的立體構型為AsO3-3,寫出一種與其互為等電子體的分子(填化學式)。
(5)某種離子型鐵的氧化物晶胞如圖2所示,它由A、B方塊組成。則該化合物中Fe2+、Fe3+、O2-的個數比為(填最簡整數比);已知該晶體的密度dg/cm3,阿伏加德羅常數的值為NA,則晶胞參數為nm(用含d和NA的代數式表示)。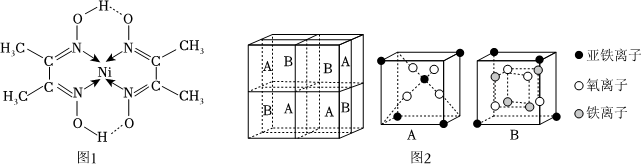 組卷:32引用:2難度:0.6
組卷:32引用:2難度:0.6


