2022年江蘇省南京市、鹽城市高考化學一模試卷
發布:2024/4/20 14:35:0
一、單項選擇題:共14題,每題3分,共42分。每題只有一個選項最符合題意。
-
1.2021年10月13日,聯合國生物多樣性大會通過《昆明宣言》,宣言承諾最遲在2030年使生物多樣性走上恢復之路,進而實現“人與自然和諧共生”的愿景。下列做法不適宜推廣的是( )
A.減少塑料袋的使用 B.開發使用清潔能源 C.垃圾分類回收利用 D.禁止使用農藥化肥 組卷:56引用:4難度:0.6 -
 2.科學家發現金星大氣中存在PH3,據此推斷金星大氣層或存在生命。利用下列反應可制備PH3,P4+3KOH(濃)+3H2O3KH2PO2+PH3↑。下列說法正確的是( )△
2.科學家發現金星大氣中存在PH3,據此推斷金星大氣層或存在生命。利用下列反應可制備PH3,P4+3KOH(濃)+3H2O3KH2PO2+PH3↑。下列說法正確的是( )△A.PH3為非極性分子 B.中子數為10的氧原子可表示為 O108C.H2O分子空間構型為V形 D.1個P4分子中含有4個σ鍵 組卷:81引用:1難度:0.7 -
3.下列鈉及其化合物的性質與用途具有對應關系的是( )
A.Na有導電性,可用作快中子反應堆的熱交換劑 B.Na2O2有強氧化性,可用于漂白 C.NaOH顯堿性,可用作干燥劑 D.NaHCO3受熱易分解,可用于治療胃酸過多 組卷:77引用:1難度:0.8 -
4.部分短周期元素的原子半徑及主要化合價見表。下列有關說法正確的是( )
元素 X Y Z W T 原子半徑/nm 0.160 0.143 0.102 0.071 0.099 主要化合價 +2 +3 +6、-2 -1 -1 A.元素X的第一電離能比Y的大 B.元素Z的電負性比W的大 C.元素W的氣態氫化物沸點比T的低 D.元素T的氧化物對應水化物的酸性一定比Z的強 組卷:99引用:2難度:0.5 -
5.SO2既是大氣主要污染物之一,又在生產生活中具有廣泛應用,如可生產SO3并進而制得硫酸等,其反應原理為:2SO2(g)+O2(g)=2SO3(g)ΔH=-196.6kJ?mol-1。實驗室可用銅和濃硫酸制取SO2。對于反應2SO2(g)+O2(g)?2SO3(g),下列說法正確的是( )
A.該反應在任何條件下都能自發進行 B.反應達平衡后再通入O2,SO3的體積分數一定增加 C.反應在高溫、催化劑條件下進行可提高SO2的平衡轉化率 D.2mol SO2(g)和1mol O2(g)所含鍵能總和比2mol SO3(g)所含鍵能小 組卷:82引用:5難度:0.5 -
6.實驗室制取SO2時,下列裝置能達到實驗目的的是( )
A. 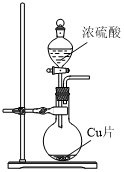
生成SO2B. 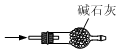
干燥SO2C. 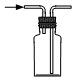
收集SO2D. 
吸收SO2組卷:58引用:4難度:0.5
二、非選擇題:共4題,共58分。
-
17.Cr(OH)3常用于顏料、陶瓷、橡膠等工業。實驗室模擬工業上以BaCrO4為原料制備Cr(OH)3的主要步驟如下。
(1)制備CrCl3。取一定質量的BaCrO4和對應量的水加入到如圖所示三頸瓶中,水浴加熱并攪拌,一段時間后同時加入過量濃鹽酸和無水乙醇充分反應,生成CrCl3并逸出CO2氣體。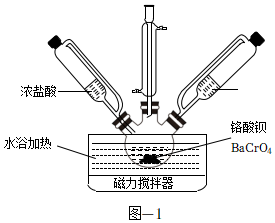
①上述反應的化學方程式為。
②在鹽酸與BaCrO4物料配比6:1、80℃條件下攪拌,反應30min。探究乙醇理論量倍數對鉻溶解率及還原率的影響如圖所示[鉻溶解率=×100%,鉻還原率=溶液中n(Cr總量)n(BaCrO4)×100%]。隨著乙醇理論量倍數的增加,鉻還原率逐漸增加、鉻溶解率幾乎不變,其原因可能是溶液中n[Cr(III)]n(BaCrO4)。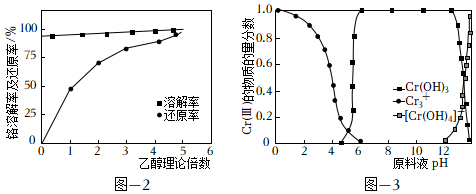
(2)制備Cr(OH)3。Cr(III)的存在形態的物質的量分數隨溶液pH的分布如圖所示。請補充完整由步驟(1)得到的CrCl3溶液制得Cr(OH)3的實驗方案:取步驟(1)得到的CrCl3溶液,,低溫烘干,得到Cr(OH)3晶體。實驗中須使用的試劑:2mol?L-1Ba(OH)2溶液、0.1mol?L-1AgNO溶液、0.1mol?L-1HNO3溶液、蒸餾水。
(3)測定Cr(OH)3樣品純度。準確稱取0.9000g樣品,溶于過量硫酸并配成250.0mL溶液。取25.00mL溶液,用足量(NH4)2S2O8溶液將Cr3+氧化為Cr2O72-,煮沸除去過量的(NH4)2S2O8,冷卻至室溫。再加入過量KI溶液,以淀粉溶液為指示劑,用0.1000mol?L-1Na2S2O3標準溶液滴定至終點,消耗Na2S2O3溶液24.00mL(已知反應:Cr2O72-+6I-+14H+=3I2+2Cr3++7H2O;I2+2S2O32-=S4O62-+2I-)。計算Cr(OH)3樣品的純度(寫出計算過程):。組卷:116引用:3難度:0.5 -
18.水溶性硝態氮(以NO3-、NO2-等形式存在)是水體污染物之一,須處理達到國家規定的標準后才能排放。
(1)在反硝化細菌作用下,用葡萄糖處理酸性廢水中的NO3-,產生兩種對大氣無污染的氣體。該反應的離子方程式為。
(2)納米鐵銅雙金屬有巨大的比表面積和很高的反應活性,可用于水體脫硝。
①納米鐵銅雙金屬與普通鐵銅雙金屬脫硝效果(以處理某硝酸鹽為例)如圖所示。在0到20min內,納米鐵銅雙金屬脫硝效果顯著,其原因可能是。
②研究表明水體中溶解氧的存在降低了納米鐵銅雙金屬脫硝的效果,驗證的實驗方案是。
(3)Jetten等人提出了利用厭氧氨氧化菌細胞中的三種酶處理廢水中NH3和NO2-的生化反應模型,其反應機理如圖所示。在NR酶和HH酶作用下的反應過程可分別描述為、。組卷:101引用:1難度:0.7


