2022-2023學年山東省濱州市高三(上)期末化學試卷
發布:2024/10/28 23:0:2
一、單選題
-
1.化學與生產、生活和科技密切相關.下列說法錯誤的是( )
A.古代的鎏金工藝利用了電鍍原理 B.疫苗一般冷藏存放以避免蛋白質變性 C.北京冬奧會采用光伏發電有利于實現“碳中和” D.“天和號”推進器上的氮化硼陶瓷屬于新型無機非金屬材料 組卷:123引用:5難度:0.6 -
2.常溫下,下列各組離子在指定溶液中能大量共存的是( )
A.中性溶液中:Al3+、Fe3+、SO42-、ClO4- B.加入鋁粉生成H2的溶液中:Na+、HCO3-、NO3-、NH4+ C.無色溶液中:K+、SO42-、Cr2O72-、Na+ D. =1×10-13mol?L-1的溶液中:NH4+、Ca2+、Cl-、NO3-Kwc平(H+)組卷:28引用:2難度:0.7 -
3.測定濃硫酸試劑中H2SO4含量的主要操作包括:①量取一定量的濃硫酸并稀釋;②轉移、定容得待測液;③移取20.00mL待測液,用0.1000mol/LNaOH溶液滴定。完成上述操作,下列儀器中不需要用到的有( )
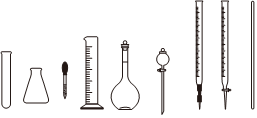
A.1種 B.2種 C.3種 D.4種 組卷:38引用:1難度:0.7 -
4.設NA為阿伏加德羅常數的值。下列關于C、Si及其化合物的敘述錯誤的是( )
A.碳元素存在12C、13C、14C等多種同位素 B.原子半徑Si大于C,使得硅原子間難以形成雙鍵 C.碳和二氧化硅反應制粗硅,每生成28g硅有2NA個硅氧鍵斷裂 D.12g金剛石中含有的晶胞數目為 NA8組卷:42引用:2難度:0.5 -
5.短周期主族元素X、Y、Z、Q的原子序數依次增大,組成的一種酸式鹽以[YX4]+[XQZ3]-的形式存在,Z、Q同主族。下列說法錯誤的是( )
A.簡單離子半徑:Q>Z>Y B.[YX4]+的空間構型為正四面體 C.第一電離能:Y>Z>Q D.Y2X4、X2Z2均為含有非極性鍵的極性分子 組卷:28引用:3難度:0.6 -
6.為完成下列各組實驗,所選玻璃儀器和試劑均準確、完整的是(不考慮存放試劑的容器)( )
實驗目的 玻璃儀器 試劑 A 精制含Ca2+、Mg2+、SO42-的食鹽水 膠頭滴管、燒杯、試管、分液漏斗 粗鹽水、稀鹽酸、氯化鋇溶液、氫氧化鈉溶液、碳酸鈉溶液 B 制備Fe(OH)3膠體 燒杯、酒精燈、膠頭滴管 1mol?L-1氫氧化鈉溶液、1mol?L-1氯化鐵溶液 C 進行淀粉水解實驗,并檢驗產物中的醛基 試管、酒精燈、膠頭滴管 淀粉溶液、稀硫酸、新制氫氧化銅懸濁液 D 利用反萃取原理從碘的四氯化碳溶液中獲取碘單質 漏斗、燒杯、玻璃棒、分液漏斗 稀硫酸、氫氧化鈉溶液 A.A B.B C.C D.D 組卷:66引用:2難度:0.5
三、填空題
-
19.清潔能源的綜合利用可有效降低碳排放,是實現“碳中和、碳達峰”的重要途徑。
(1)以環己烷為原料通過芳構化反應生產苯,同時可獲取氫氣。圖甲是該反應過程中幾種物質間的能量關系。
芳構化反應: ΔH=kJ?mol-1。
ΔH=kJ?mol-1。
(2)H2和CO2合成乙醇反應為:2CO2(g)+6H2(g)?C2H5OH(g)+3H2O(g)。將等物質的量的CO2和H2充入一剛性容器中,測得平衡時C2H5OH的體積分數隨溫度和壓強的關系如圖乙。
①壓強P1P2(填“>”“=”或“<”,下同),a、b兩點的平衡常數KaKb。
②已知Arrhenius經驗公式為Rlnk=-+C(Ea為活化能,k為速率常數,R和C為常數),為探究m、n兩種催化劑的催化效能,進行了實驗探究,依據實驗數據獲得圖丙曲線。在m催化劑作用下,該反應的活化能Ea=EaTJ?mol-1。從圖中信息獲知催化效能較高的催化劑是(填“m”或“n”),判斷理由是。
(3)H2和CO合成甲烷反應為:2CO(g)+2H2(g)?CH4(g)+CO2(g)。T℃將等物質的量CO和H2充入恒壓(200Kpa)的密閉容器中。已知逆反應速率v逆=K逆p(CH4)?p(CO2),其中p為分壓,該溫度下K逆=5.0×10-4kPa-1?s-1。反應達平衡時測得v正=kPa?s-1。CO的平衡轉化率為516,該溫度下反應的Kp=(kPa)-2(用組分的分壓計算的平衡常數)。組卷:109引用:5難度:0.3 -
20.TiCl4是制備金屬鈦的重要中間體。實驗室制備TiCl4的裝置如圖(夾持裝置略去)。
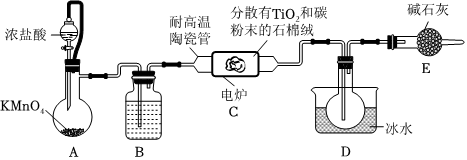
已知:
Ⅰ.HCl與TiO2不發生反應;裝置C中除生成TiCl4外,同時還生成CO和少量CCl4。
Ⅱ.TiCl4的熔、沸點分別為-25℃、136.45℃,遇潮濕空氣產生白色煙霧;CCl4的熔、沸點分別為-23℃、76.8℃,與TiCl4互溶。
請回答下列問題:
(1)裝置B中所盛試劑為,裝置C中反應的化學方程式為。
(2)組裝好儀器后,部分實驗步驟如下:
a.裝入藥品
b.打開分液漏斗活塞
c.檢查裝置氣密性
d.關閉分液漏斗活塞
e.停止加熱,充分冷卻
f.加熱裝置C中陶瓷管
正確操作順序為(不重復使用)。
(3)實驗結束后分離裝置D中燒瓶內的液態混合物的操作是(填操作名稱)。
(4)該裝置存在的缺陷是。
(5)TiCl4可用于制備納米TiO2。測定產品中TiO2純度的方法是:準確稱取0.2000g樣品放入錐形瓶中,加入硫酸和硫酸銨混合溶液,加強熱使其溶解。冷卻后,加入一定量稀鹽酸得到含TiO2+溶液。加入金屬鋁,將TiO2+全部轉化為Ti3+。待過量金屬鋁完全溶解并冷卻后,加入指示劑,用0.1000mol?L-1NH4Fe(SO4)2標準溶液滴定至終點,將Ti3+氧化為TiO2+。重復操作2~3次,消耗標準溶液平均體積為20.00mL。
①加入金屬鋁的作用除了還原TiO2+外,另一個作用是。
②滴定時所用的指示劑為(填標號)。
a.酚酞溶液
b.KSCN溶液
c.KMnO4溶液
d.淀粉溶液
③樣品中TiO2的純度為。組卷:64引用:4難度:0.5


