2022-2023學年重慶市育才中學高三(上)開學化學試卷
發布:2024/12/27 9:30:2
一、選擇題(每題只有一個選項正確,每題3分,共42分)
-
1.化學與生活密切相關。下列說法錯誤的是( )
A.純堿和Al(OH)3都可以用作胃酸中和劑,制胃藥 B.工人將模具干燥后再注入熔融鋼水,原因是鐵在高溫下會與H2O反應 C.LiH過是一種常見的儲氫材料,它與水的反應中,水是氧化劑,LiH是還原劑 D.《本草經集注》中關于鑒別硝石(KNO3)和樸硝(Na2SO4)的記載:“以火燒之,紫青煙起,乃真硝石也”,該方法應用了焰色反應 組卷:8引用:2難度:0.6 -
2.能將Na+、Al3+、Mg2+、Fe3+四種離子的溶液一次性鑒別開來的試劑是( )
A.NaCl 溶液 B.NaOH溶液 C.氨水 D.NaHCO3溶液 組卷:15引用:3難度:0.5 -
3.下列說法正確的是( )
A.Be原子最外層電子的電子云輪廓圖為 
B.基態Mn2+的核外電子排布式為1s22s22p63s23p63d54s2 C.Fe3+的價電子的軌道表示式: 
D.砷原子的原子結構示意圖:  組卷:37引用:2難度:0.6
組卷:37引用:2難度:0.6 -
4.下列說法正確的是( )
A.NH3的VSEPR模型為四面體形,屬于極性分子 B.C2H4中σ鍵類型為“頭碰頭”形式形成的s-pσ鍵和p-pσ鍵 C.P4的空間構型為正四面體形,鍵角是109°28′ D.Li+、O2-、Na+的離子半徑依次增大 組卷:33引用:2難度:0.7 -
5.阿伏加德羅常數的值為NA,下列說法正確的是( )
A.1mol Na2O2中陰離子個數為2NA B.56g鐵在足量氧氣中完全燃燒,轉移的電子數為3NA C.1mol Cu與2mol濃硫酸反應,生成NA個SO2分子 D.1mol Na2O2與足量CO2充分反應,轉移的電子數為NA 組卷:18引用:3難度:0.6 -
6.下列物質的轉化在給定條件下能實現的是( )
①Al2O3NaAlO2NaOH△Al(OH)3CO2
②SSO3O2點燃H2SO4H2O
③飽和NaCl(aq)NaHCO3NH3,CO2Na2CO3△
④Fe2O3FeCl3(aq)HCl(aq)無水FeCl3△
⑤MgCl2Mg(OH)2石灰乳MgO煅燒A.①③⑤ B.②③④ C.②④⑤ D.①④⑤ 組卷:74引用:1難度:0.8
二、解答題(共4小題,滿分58分)
-
17.氮化鋁(AlN)是一種性能優異的新型材料,在許多領域有廣泛應用,前景廣闊。某化學小組模擬工業制氮化鋁原理欲在實驗室制備氮化鋁并檢驗其純度。
查閱資料:
①實驗室用飽和NaNO2溶液與NH4Cl溶液共熱制N2:
NaNO2+NH4ClNaCl+N2↑+2H2O△
②工業制氮化鋁:Al2O3+3C+N22AlN+3CO,氮化鋁在高溫下能水解。高溫
③AlN與NaOH飽和溶液反應:AlN+NaOH+H2O=NaAlO2+NH3↑。
Ⅰ.氮化鋁的制備
(1)實驗中使用的裝置如上圖所示,請按照氮氣氣流方向將各儀器接口連接:e→c→d→a→b→(根據實驗需要,上述裝置可使用多次)。
(2)B裝置內的X液體可能是,E裝置內氯化鈀溶液的作用可能是。
Ⅱ.氮化鋁純度的測定
【方案i】甲同學用下圖裝置測定AlN的純度(部分夾持裝置已略去)。
(3)為準確測定生成氣體的體積,量氣裝置(虛線框內)中的Y液體可以是。
a.CCl4 b.H2O c.NH4Cl飽和溶液 d.植物油
(4)若裝置中分液漏斗與導氣管之間沒有導管A連通,對所測AlN純度的影響是(填“偏大”“偏小”或“不變”)
【方案ii】乙同學按以下步驟測定樣品中AlN的純度。
(5)步驟②通入過量氣體。
(6)步驟③過濾所需要的主要玻璃儀器有。
(7)樣品中AlN的純度是(用含m1、m2、m3的表達式表示)。組卷:74引用:5難度:0.4 -
18.Ⅰ.由CO2、甲醇為原料合成綠色化學品碳酸二甲酯(
 )的過程如圖,請回答下列問題:
)的過程如圖,請回答下列問題:
(1)下列說法不正確的是(填字母)。
A.上述過程a中,從反應物到產物,C和N元素的雜化方式均保持不變
B.NH3極易溶解在水中,只因氨分子與水分子間形成了氫鍵
C.尿素的沸點比碳酸二甲酯的高,主要原因為前者能形成分子間氫鍵,而后者不能形成分子間氫鍵
Ⅱ.硫元素在化合物中常表現出多種化合價,它的許多化合物在研究和生產中有許多重要用途。回答下列問題:
(2)S單質的常見形式為S8,其環狀結構如圖所示,S原子的雜化軌道類型是。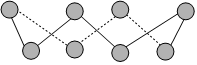
(3)CS2的電子式是,依據VSEPR理論推測CS2的空間構型為,常溫下CO2是氣體而CS2是液體的原因是。
(4)H2O的鍵角H2S的鍵角(填“大于”或“小于”),理由是。
(5)ZnS在熒光體、光導體材料、涂料、顏料等行業中應用廣泛,立方ZnS晶體結構如圖所示。
①已知A、B點的原子坐標分別為(0,0,0)和,則C點的原子坐標為(1,12,12);
②若晶胞棱長為apm,密度為g?cm-3(NA表示阿伏加德羅常數的值)。組卷:3引用:2難度:0.6


