2020-2021學年福建省廈門一中高三(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題
-
1.《本草經集注》記載:“雞屎礬(堿式硫酸銅或堿式碳酸銅)不入藥用,惟堪鍍作,以合熟銅;投苦酒(醋)中,涂鐵皆作銅色,外雖銅色,內質不變”。下列說法錯誤的是( )
A.雞屎礬中主要成分屬于堿式鹽 B.堿式碳酸銅不穩定,受熱易分解 C.“涂鐵皆作銅色”發生反應為置換反應 D.“內質不變”說明出現了鈍化現象 組卷:76引用:5難度:0.8 -
2.下列有關化學用語表示正確的是( )
A.H2O2的電子式:H+[  ]2-H+
]2-H+B.Cl-的結構示意圖: 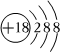
C.原子核中有10個中子的氧離子: O2-188D.HClO的結構式:H-Cl-O 組卷:28引用:10難度:0.9 -
3.化學與人類生活密切相關。下列說法錯誤的是( )
A.二氧化硫可做漂白劑、防腐劑,還是一種食品添加劑 B.碳酸鈉與碳酸氫鈉均能與酸反應,均常用作發酵粉 C.補鐵口服液是常見的補鐵劑,可與維生素C同時服用 D.汽車尾氣中的氮氧化物與碳氫化合物反應可形成光化學煙霧 組卷:1引用:1難度:0.7 -
4.某中德聯合研究小組設計制造了一種“水瓶”,用富勒烯(C60)的球形籠子作“瓶體”,一種磷酸鹽作“瓶蓋”,恰好可將一個水分子關在里面。下列說法正確的是( )
A.“水瓶”、冰水混合物、CuSO4?5H2O都是混合物 B.金剛石、石墨和C60互稱為同素異形體,其中金剛石更穩定 C.磷酸鈣是難溶性弱電解質 D.一定條件下石墨轉化為C60是化學變化,屬于有單質參加的非氧化還原反應 組卷:129引用:8難度:0.7 -
5.下列有關說法正確的是( )
A.反應Hg(1)+H2SO4(aq)═HgSO4(aq)+H2(g)在常溫下不能自發進行,則△H<0 B.在海輪外殼連接鋅塊保護外殼不受腐蝕是采用了犧牲陽極的陰極保護法 C.SnCl2+H2O?Sn(OH)Cl↓+HCl配制氯化亞錫溶液時加入NaOH固體 D.當鍍錫鐵制品的鍍層破損時,鍍層仍能對鐵制品起保護作用 組卷:15引用:2難度:0.8 -
6.用化學沉淀法去除粗鹽中的雜質離子,包括粗鹽溶解、加沉淀劑、過濾、調節pH、蒸發結晶等步驟。下列說法錯誤的是( )
A.沉淀劑的添加順序可以是NaOH溶液、BaCl2溶液、Na2CO3溶液 B.向濾液中滴加鹽酸,調節pH至濾液呈中性 C.蒸發結晶時,當蒸發皿中出現較多固體時,停止加熱,利用余熱將濾液蒸干 D.溶解、過濾、蒸發結晶等過程都使用玻璃棒攪拌溶液 組卷:80引用:3難度:0.7
二、填空題
-
19.PCl3主要用于制造敵百蟲等有機磷農藥和磺胺嘧啶(S.D)等醫藥的原料。下圖為實驗室中制取粗PCl3產品的裝置,夾持裝置略去。經查閱資料知:紅磷與少量Cl2反應生成PCl3,與過量Cl2反應生成PCl5.PCl3遇水會強烈水解生成H3PO3.PCl3遇O2會生成POCl3(三氯氧磷),PCl3、POCl3的熔沸點見表。
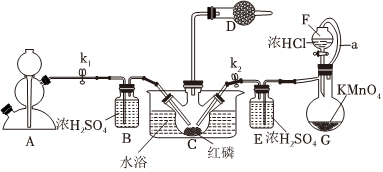
回答下列問題:物質 熔點/℃ 沸點/℃ PCl3 -112 75.5 POCl3 2 105.3
(1)儀器G的名稱是。裝置F與G由橡膠管a相連通,a的作用是。
(2)A是制取CO2裝置,CO2的作用是,選擇A中的藥品是(填字母)。
a.稀鹽酸 b.稀硫酸 c.NaHCO3粉末 d.塊狀石灰石
(3)裝置D中盛有堿石灰,其作用是。
(4)裝置G中生成Cl2,反應的離子方程式為。
(5)裝置C采用65-70℃水浴加熱,制得的PCl3粗產品中常含有POCl3、PCl5等雜質,除雜的方法是:先加入紅磷加熱,除去PCl5,然后通過(填實驗操作名稱),即可得到較純凈的PCl3。
(6)通過實驗測定粗產品中PCl3的質量分數,實驗步驟如下(不考慮雜質的反應):
第一步:迅速移取20.0 g PCl3粗產品,加水完全水解后,再配成500mL溶液;
第二步:移取25.00mL溶液置于錐形瓶中;
第三步:加入0.5mol?L-1碘溶液20 mL,碘過量,H3PO3完全反應生成H3PO4;
第四步:加入幾滴淀粉溶液,用1.0 mol?L-1Na2S2O3標準溶液滴定過量的碘,反應方程式為I2+2Na2S2O3═Na2S4O6+2NaI,滴至終點時消耗Na2S2O3標準溶液12mL。
①第三步中反應的化學方程式為。
②根據上述數據,計算該產品中PCl3的質量分數為%。組卷:8引用:3難度:0.4 -
20.霧霾由多種污染物形成,包含顆粒物(PM2.5)、氮氧化物(NOx)、CO、SO2等。化學在解決霧霾污染問題中有著重要的作用。
(1)已知:①2CO(g)+O2(g)═2CO2(g) ΔH1=-566.0kJ?mol-1
②N2(g)+2O2(g)═2NO2(g) ΔH2=+64kJ?mol-1
反應2NO2(g)+4CO(g)═N2(g)+4CO2(g)在(填“高溫”或“低溫”)條件下能自發進行。
(2)研究發現利用NH3可除去硝酸工業尾氣中的NO。NH3與NO的物質的量之比分別為1:2、1:1.5、3:1時,NO脫除率隨溫度變化的曲線如圖1所示。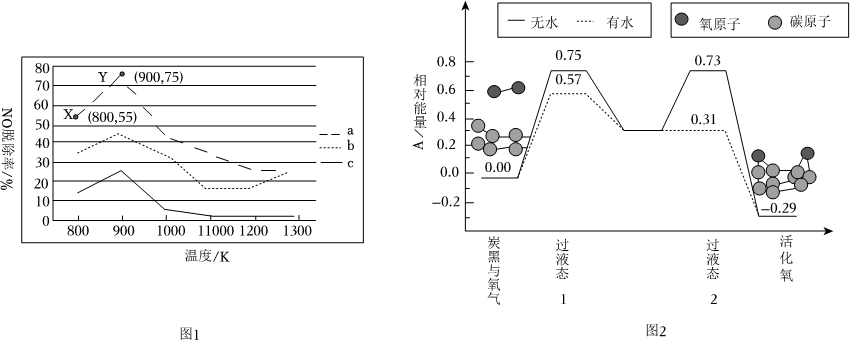
①曲線a中,NO的起始濃度為6×10-4mg?m-3,若從X點到Y點經過20s,則該時間段內NO的脫除速率為mg?m-3?s-1。
②曲線c對應的NH3與NO的物質的量之比是,其理由是。
(3)炭黑可以活化O2(g),生成活化O(g)。可表示為O2(g)?2O(g) ΔH。1個O2(g)活化過程中的能量變化模擬計算結果如圖2所示。下列說法正確的是。
A.水的加入不改變該反應的焓變
B.水的加入改變了該反應中間體的能量
C.有水狀態下該反應的活化能為0.88eV
D.有水狀態更容易活化氧分子
(4)若反應2NO(g)+2CO(g)?N2(g)+2CO2(g)的正、逆反應速率分別可表示為v正=k正c2(NO)?c2(CO);v逆=k逆c(N2)?c2(CO2),k正、k逆分別為正、逆反應速率常數,c為物質的量濃度。一定溫度下,在體積為1L的恒容密閉容器中加入4molNO和4molCO發生上述反應,測得CO和CO2的物質的量濃度隨時間的變化如圖3所示。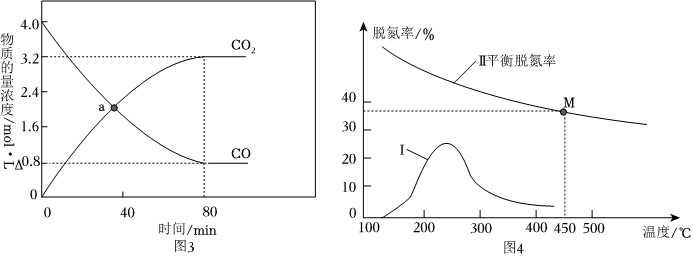
①下列說法中可以證明上述反應已達到平衡狀態的是。
A.混合氣體的顏色不再改變
B.混合氣體的密度不再改變
C.混合氣體的平均分子量不再改變
D.2v正(N2)=v逆(CO2)
②為探究該反應中催化劑對脫氮率( NO的轉化率)的影響。將等物質的量NO和CO以一定的流速通過催化劑a,假設只發生反應2NO(g)+2CO(g)?N2(g)+2CO2(g) ΔH<0。相同時間、不同溫度下測得使用催化劑a時脫氮率與溫度的關系如圖4中曲線Ⅰ所示。請分析脫氮率隨溫度升高先增加后減少的可能原因為。組卷:9引用:1難度:0.5


