2020-2021學年福建省福州四中高二(下)期末化學試卷
發布:2025/1/6 5:0:2
一、選擇題(每小題只有一個選項符合題意,1-10題,每小圖2分:11-20題,每小題2分。共50分)
-
1.下列表達方式正確的是( )
A.次氯酸的電子式: 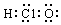
B.24Cr的外圍電子排布式:3d44s2 C.N原子的核外電子軌道表示式為: 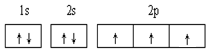
D.CO2的立體結構模型 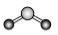 組卷:6引用:1難度:0.7
組卷:6引用:1難度:0.7 -
2.下列各組物質各自形成晶體,均屬于分子晶體的化合物是( )
A.PCl3、CO2、SiO2 B.C2H4、HD、NH3 C.H2SO4、H2O2、Na2O2 D.CCl4、SO2、NH3 組卷:47引用:1難度:0.8 -
3.下列說法錯誤的是( )
A.(n-1)p電子的能量不一定低于ns電子的能量 B.Se電子排布式:1s12s22p33s43p33d3,違反了能量最低原理 C.Ti電子排布式:1s22s22p43s23p14,違反了泡利原理 D.6C電子排布式:1s22s22p2x,違反了洪特規則 組卷:70引用:1難度:0.6 -
4.某元素基態原子電子排布式為[Ar]3d64s2,它在元素周期表中的位置是( )
A.第3周期ⅡB族 B.第4周期ⅡB族 C.第4周期ⅦB族 D.第4周期Ⅷ族 組卷:10引用:5難度:0.6 -
5.下列分子或離子中鍵角由大到小排列順序的是( )
①BCl3
②NH3
③H2O
④CH4
⑤BeCl2A.⑤④①②③ B.⑤①④②③ C.④①②⑤③ D.③②④①⑤ 組卷:183引用:7難度:0.9 -
6.下列物質中σ鍵和π鍵數目比為1:2的是( )
A.O2 B.HCN C.CO D.CH2=CH2 組卷:209引用:3難度:0.3 -
7.下面的排序不正確的是( )
A.晶體熔點由低到高:CF4<CCl4<CBr4<CI4 B.硬度由大到小:金剛石>碳化硅>晶體硅 C.熔點由高到低:Na>Mg>Al D.晶格能由大到小:NaF>NaCl>NaBr>NaI 組卷:217引用:39難度:0.7 -
8.下列每組物質發生狀態變化時,克服粒子間的相互作用力屬于同種類型的是( )
A.食鹽和蔗糖熔化 B.氫氧化鈉和單質硫熔化 C.碘和干冰升華 D.二氧化硅和氧化鈉熔化 組卷:15引用:2難度:0.6
二、填空題(本題共4小題,共50分)
-
23.20世紀50年代科學家提出價層電子對互斥模型(簡稱VSEPR模型),用于預測簡單分子立體結構。其要點可以概括為:
Ⅰ.用AXnEm表示只含一個中心原子的分子組成,A為中心原子,X為與中心原子相結合的原子,E為中心原子最外層未參與成鍵的電子對(稱為孤對電子),(n+m)稱為價層電子對數。分子中的價層電子對總是互相排斥,均勻的分布在中心原子周圍的空間;
Ⅱ.分子的立體構型是指分子中的原子在空間的排布,不包括中心原子未成鍵的孤對電子;
Ⅲ.分子中價層電子對之間的斥力主要順序為:i、孤對電子之間的斥力>孤對電子對與共用電子對之間的斥力>共用電子對之間的斥力;ii、雙鍵與雙鍵之間的斥力>雙鍵與單鍵之間的斥力>單鍵與單鍵之間的斥力;iii、X原子得電子能力越弱,A-X形成的共用電子對之間的斥力越強;iv、其他。
請仔細閱讀上述材料,回答下列問題:
(1)NH4+與CO32-的空間構型:NH4+;CO32-。
(2)有兩種活性反應中間體微粒,它們的微粒中均含有1個碳原子和3個氨原子。請依據下面給出的這兩種微粒的球棍模型,寫出相應的化學式: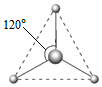 ;
;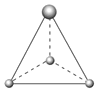 。
。
(3)按要求寫出第二周期非金屬元素構成的中性分子的化學式:
平面三角形分子,三角錐形分子,四面體形分子。
(4)硼酸晶體構型為平面層狀結構(如圖Ⅰ)。四硼酸根為立體結構(如圖Ⅱ)。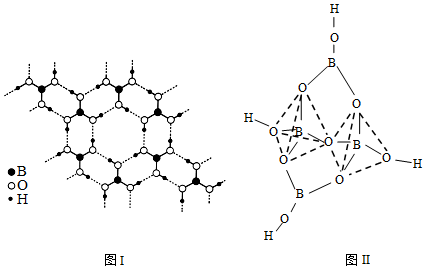
①硼酸為晶體:晶體中各層之間的作用力為。
②四硼酸根中硼原子的雜化方式為。
③與B、O同周期,第一電離能介于二者之間的有(填元素符號)。組卷:24引用:2難度:0.4 -
24.2019年諾貝爾化學獎給了三位為鋰離子電池發展做出重要貢獻的科學家。鋰離子電池的正極材料主要有層狀結構的LiMO2,尖晶石結構的LiM2O4以及橄欖石型的LiMPO4(M=Fe、Mn、Ni、Co等元素)。
(1)N、O、P的電負性由大到小的順序為。第三電離能I3(Mn)I3(Fe)(填“>”或“<”)。
(2)基態Co原子核外電子排布式為;Co3+的一種配離子[Co(N3)(NH3)5]2+中,Co3+的配位數是,配位體中心原子雜化類型是N-3。
(3)MnO的熔點(1650℃)比MnS的熔點(1610℃)高,它們含有的化學鍵類型是。前者熔點較高的原因是。
(4)磷元素和鋁元素形成的化合物AIP因殺蟲效率高、廉價易得而被廣泛使用。已知AlP的熔點為2000℃,其晶胞結構如圖所示。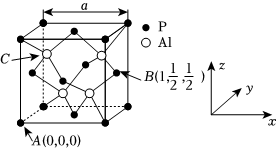
①磷化鋁的晶體類型為。
②A、B點的原子坐標如圖所示,則C點的原子坐標為。
③磷化鋁的晶胞參數a=546.35pm,其密度為g?cm-3(列出計算式即可,用NA表示阿伏加德羅常數的值)組卷:30引用:3難度:0.5


