魯科版(2019)高二(上)《模塊備考方略》(選擇性必修1 化學反應原理)(27)
發布:2024/8/17 12:0:1
一、選擇題
-
1.在放熱反應的平衡體系中升高溫度,平衡常數將會( )
A.增大 B.減小 C.不變 D.無法判斷 組卷:63引用:1難度:0.9 -
2.NA代表阿伏加德羅常數的值。下列說法正確的是( )
A.25℃時pH=12的KOH溶液中含有OH-的數目為0.01NA B.用惰性電極電解飽和氯化鈉溶液,陰極放出22.4LH2,轉移電子數目為2NA C.1L0.1mol?L-1的Na3PO4溶液中,所含 的數目小于0.1NAPO3-4D.電解精煉銅,陽極溶解銅6.4g時,陰極得電子數目為0.2NA 組卷:2引用:2難度:0.6 -
3.下列關于電解質溶液和離子反應敘述中錯誤的是( )
A.Mg(OH)2沉淀既可以用鹽酸也可以用NH4Cl溶液來溶解 B.某溶液加Al粉可以生成氫氣,則溶液中可能大量存在Na+、 、Cl-NO-3C.已知H2A=H++HA-,HA-?H++A2-,則NaHA溶液一定顯酸性 D.向NH4HCO3中加入足量NaOH溶液,則離子方程式為 +OH-=NH3?H2ONH+4組卷:46引用:3難度:0.7 -
4.工業制硫酸中一步重要反應是SO2在加熱條件下催化氧化:2SO2+O2
2SO3,這是一個正反應放熱的可逆反應。若反應在密閉容器中進行,下列有關說法錯誤的是( )催化劑△A.使用催化劑是為了加快反應速率,提高生產效率 B.在上述條件下,SO2不可能100%轉化為SO3 C.為了提高SO2的轉化率,應適當提高O2的濃度 D.反應達到平衡時,SO2的濃度與SO3的濃度一定相等 組卷:3引用:2難度:0.5 -
5.下列事實中一定能證明HClO是弱電解質的是( )
(1)pH相等的H2SO4和HClO與足量的強堿反應,HClO消耗的強堿體積大
(2)用HClO溶液做導電性實驗,燈泡很暗
(3)NaClO溶液中有HClO分子存在
(4)HClO溶液有很強的氧化性
(5)等體積,等物質的量濃度的HClO與NaOH溶液恰好完全反應
(6)鹽酸與KClO溶液反應生成HClO
(7)1mol/L的HClO溶液能使紫色石蕊試液先變紅后褪色.A.(1)(2)(3) B.(1)(3)(6) C.(1)(2)(5)(6) D.(1)(3)(6)(7) 組卷:7引用:2難度:0.7 -
6.向四支試管中分別加入少量不同的無色溶液進行如下操作,結論正確的是( )
操作 現象 結論 A 滴加BaCl2溶液 生成白色沉淀 原溶液中有 SO2-4B 滴加氯水和CCl4,振蕩、靜置 下層溶液顯紫紅色 原溶液中有I- C 用潔凈鉑絲蘸取溶液進行焰色反應 火焰呈黃色 原溶液中有Na+、無K+ D 滴加Ba(NO3)2溶液生成白色沉淀,再加稀鹽酸 沉淀不溶解 原溶液中無 SO2-4A.A B.B C.C D.D 組卷:10引用:2難度:0.7
四、解答題
-
19.(1)以太陽能為熱源,熱化學硫碘循環分解水是一種高效、環保的制氫方法,其流程圖如圖1所示。
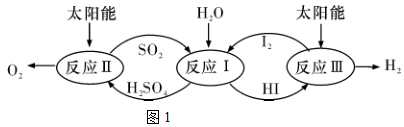
相關反應的熱化學方程式為
反應Ⅰ:SO2(g)+I2(g)+2H2O(l)═2HI(aq)+H2SO4(aq)ΔH1=-213kJ?mol-1
反應Ⅱ:H2SO4(aq)═SO2(g)+H2O(l)+O2(g)ΔH2=+327kJ?mol-112
反應Ⅲ:2HI(aq)═H2(g)+I2(g)ΔH3=+172kJ?mol-1
則反應2H2O(l)═2H2(g)+O2(g)ΔH=。
(2)一定條件下,甲烷與水蒸氣發生反應:CH4(g)+H2O(g)?CO(g)+3H2(g),工業上可利用此反應生產合成氨的原料氣H2。
①一定溫度下,向2L恒容密閉容器中充入1.6molCH4和2.4molH2O(g)發生上述反應,CO(g)的物質的量隨時間的變化如圖2所示。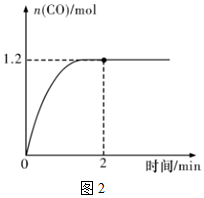
0~2 min內的平均反應速率v(H2)=mol?L-1?min-1,平衡時CH4的轉化率為。
②若要進一步提高該反應的化學反應速率,除了使用催化劑和升高溫度外,還可以采取的措施有(任寫一條)。
③下列能說明上述反應達到平衡狀態的是(填標號)。
a.v逆(CH4)=3v正(H2)
b.恒溫恒容時,容器內混合氣體的密度保持不變
c.CH4(g)、H2O(g)的濃度保持不變
d。CH4(g)、H2O(g)、CO(g)、H2(g)的物質的量之比為1:1:1:3
e.斷開3molH-H鍵的同時斷開2molO-H鍵組卷:18引用:3難度:0.5 -
20.化學上把外加少量酸、堿,而pH基本不變的溶液,稱為緩沖溶液。現有25℃時,濃度均為0.10mol/L的CH3COOH和CH3COONa的緩沖溶液,pH=4.76,已知:Ka(CH3COOH)=1.75×10-5,Kb為鹽的水解常數。回答下列問題:
(1)寫出CH3COONa水解的離子方程式。
(2)該緩沖溶液中除水分子外,所有粒子濃度由大到小的順序。
(3)25℃時,Ka(CH3COOH)Kb(CH3COO-)(填“>”、“<”或“=”)。
(4)人體血液存在H2CO3(CO2)與NaHCO3的緩沖體系,能有效除掉人體正常代謝產生的酸、堿,保持pH的穩定,有關機理說法正確的是(填寫選項字母)。
a.代謝產生的H+被結合形成H2CO3HCO-3
b.血液中的緩沖體系可抵抗大量酸、堿的影響
c.代謝產生的堿被H2CO3中和轉化為HCO-3組卷:10引用:2難度:0.6


