2019-2020學年北京市昌平區新學道臨川學校高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(2×25=40,每小題只有一個正確的選項)
-
1.下列說法正確的是( )
A.需要加熱才能發生的反應一定是吸熱反應 B.化學反應中的能量變化都表現為熱量變化 C.任何放熱反應在常溫下一定能發生反應 D.反應物和生成物所具有的總能量決定了反應是放熱還是吸熱 組卷:736引用:27難度:0.9 -
2.10月24日“嫦娥一號”發射升空,在三級動力中采用了氫氧燃料.已知在1×105Pa,298K條件下,2mol氫氣燃燒生成水蒸氣放出484kJ熱量,下列熱化學方程式正確的是( )
A.H2O(g)═H2(g)+ O2(g)△H=+242kJ?mol-112B.2H2(g)+O2(g)═2H2O(l)△H=-484kJ?mol-1 C.H2(g)+ O2(g)═H2O(g)△H=+242kJ?mol-112D.2H2(g)+O2(g)═2H2O(g)△H=+484kJ?mol-1 組卷:24引用:10難度:0.9 -
3.未來新能源的特點是資源豐富,在使用時對環境無污染或很少污染,且有些可以再生.下列屬于新能源的是( )
①天然氣 ②煤 ③核能 ④石油 ⑤太陽能 ⑥燃料電池 ⑦風能 ⑧氫能.A.①②③④ B.⑤⑥⑦⑧ C.③④⑤⑥ D.除①②外 組卷:36引用:7難度:0.9 -
4.下列反應中生成物總能量高于反應物總能量的是( )
A.鋁粉與氧化鐵粉末反應 B.乙醇燃燒 C.碳酸鈣受熱分解 D.氧化鈣溶于水 組卷:39引用:179難度:0.9 -
5.在2L的密閉容器中,發生以下反應:2A(g)+B(g)?2C(g)+D(g),若最初加入的A和B都是4mol,在前10s A的平均反應速率為0.12mol/(L?s),則10s時,容器中B的物質的量是( )
A.3.4 mol B.3.2 mol C.2.8 mol D.1.2 mol 組卷:228引用:25難度:0.9 -
6.對于可逆反應4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列敘述正確的是( )
A.達到化學平衡時,4υ正(O2)=5υ逆(NO) B.若單位時間內生成xmolNO的同時,消耗xmolNH3,則反應達到平衡狀態 C.達到化學平衡時,若增加容器體積,則正反應速率減小,逆反應速率增大 D.化學反應速率關系是:2υ正(NH3)=3υ正(H2O) 組卷:309引用:53難度:0.7 -
7.已知反應A2(g)+2B2(g)?2AB2(g)△H<0,下列說法正確的是( )
A.升高溫度,正向反應速率增加,逆向反應速率減小 B.升高溫度有利于反應速率增加,從而縮短達到平衡的時間 C.達到平衡后,升高溫度或增大壓強都有利于該反應平衡正向移動 D.達到平衡后,降低溫度或減小壓強都有利于該反應平衡正向移動 組卷:1169引用:136難度:0.9 -
8.已知:4NH3(g)+5O2(g)═4NO(g)+6H2O(g);該反應是一個可逆反應,正反應是放熱反應.若反應物起始物質的量相同,下列關于該反應的示意圖不正確的是( )
A. 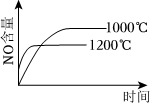
B. 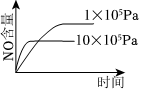
C. 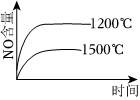
D. 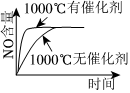 組卷:19引用:12難度:0.7
組卷:19引用:12難度:0.7 -
9.下列各組離子在溶液中一定能大量共存的是( )
A.PH=0的溶液:K+、Ca2+、HCO3-、NO3- B.c(H+水)=1×10-10 mol/L溶液中:K+、Fe2+、SO42-、NO3- C.使紫色石蕊變藍的溶液:K+、Na+、CH3COO-、SO42- D.存在較多的Na+、SO42-、OH-的溶液中:Mg2+、Ba2+、Br- 組卷:9引用:7難度:0.7
三.填空題(3個共36分)
-
 28.25℃時,部分物質的電離平衡常數如表所示:
28.25℃時,部分物質的電離平衡常數如表所示:
請回答下列問題:化學式 CH3COOH H2CO3 HClO 電離平衡常數 1.7×10-5mol?L-1 K1=4.4×10-7mol?L-1
K2=5.6×10-11mol?L-13.0×10-8
mol?L-1
(1)同濃度的CH3COO-、HCO3-、CO32-、ClO-結合H+的能力由強到弱的順序為。
(2)常溫下0.1mol?L-1的CH3COOH溶液在加水稀釋過程中,下列表達式的數據一定變小的是(填字母序號,下同)。
A.c(H+) B.C.c(H+)?c(OH-)c(H+)c(CH3COOH)
D.E.c(OH-)c(H+)c(CH3COO-)?c(H+)c(CH3COOH)
若該溶液升高溫度,上述5種表達式的數據增大的是。
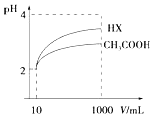
(3)體積為10mL pH=2的醋酸溶液與一元酸HX溶液分別加水稀釋至1000mL,稀釋過程pH變化如圖:則HX的電離平衡常數(填“大于”、“等于”或“小于”)醋酸的平衡常數。稀釋后,HX溶液中由水電離出來的c(H+)(填“大于”、“等于”或“小于”)醋酸的溶液中由水電離出來的c(H+),理由是。
(4)已知100℃時,水的離子積為1×10-12,該溫度下測得某溶液pH=7,該溶液顯(填“酸”、“堿”或“中”)性。將此溫度下pH=1的H2SO4溶液aL與pH=11的NaOH溶液bL混合,若所得混合液pH=2,則a:b=。組卷:35引用:4難度:0.3
四、實驗題(1個共14分)
-
 29.某學生欲用已知物質的量濃度的鹽酸來測定未知物質的量濃度的氫氧化鈉溶液,請填寫下列空白:
29.某學生欲用已知物質的量濃度的鹽酸來測定未知物質的量濃度的氫氧化鈉溶液,請填寫下列空白:
(1)選用的指示劑是.
(2)用標準的鹽酸溶液滴定待測的氫氧化鈉溶液時,左手把握酸式滴定管的活塞,右手搖動錐形瓶,眼睛注視.
(3)下列操作中可能使所測氫氧化鈉溶液的濃度數值偏低的是.
A.酸式滴定管未用標準鹽酸溶液潤洗就直接注入標準鹽酸溶液
B.滴定前盛放氫氧化鈉溶液的錐形瓶用蒸餾水洗凈后沒有干燥
C.酸式滴定管在滴定前有氣泡,滴定后氣泡消失
D.讀取鹽酸體積時,開始仰視讀數,滴定結束時俯視讀數
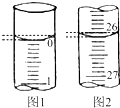
(4)若滴定開始和結束時,酸式滴定管中的液面如圖所示,請將數據填入下面表格的空白處.
(5)請根據上表中數據列式計算該氫氧化鈉溶液的物質的量濃度:c(NaOH)=滴定次數 待測氫氧化鈉溶液的體積/mL 0.1000mol/L 鹽酸的體積/mL 滴定前刻度 滴定后刻度 溶液體積/mL 第一次 25.00 第二次 25.00 2.00 28.08 26.08 第三次 25.00 0.22 26.34 26.12 .
(6)滴定終點的判定依據是.組卷:72引用:3難度:0.1


