2022-2023學(xué)年北京四中高三(上)期中化學(xué)試卷
發(fā)布:2024/11/22 4:0:1
一、選擇題(每小題只有1個(gè)選項(xiàng)符合題意,每小題3分,共42分)
-
1.第24屆冬季奧林匹克運(yùn)動(dòng)會(huì)即將在北京開幕。雪上項(xiàng)目是冬奧會(huì)重要項(xiàng)目之一。制作滑雪板各部分所對(duì)應(yīng)的材料中,屬于天然有機(jī)高分子的是( )
A.板面——尼龍 B.板芯——木質(zhì) C.板底——聚乙烯塑料 D.復(fù)合層——玻璃纖維 組卷:56引用:4難度:0.7 -
2.下列說(shuō)法正確的是( )
A.硫酸銨和醋酸鉛溶液均可使雞蛋清溶液中的蛋白質(zhì)變性 B.麥芽糖與蔗糖的水解產(chǎn)物均含葡萄糖,故二者均為還原型二糖 C.天然植物油常溫下一般呈液態(tài),難溶于水,有恒定的熔點(diǎn)、沸點(diǎn) D.蛋白質(zhì)的鹽析可用于分離和提純蛋白質(zhì) 組卷:55引用:2難度:0.7 -
3.下列離子檢驗(yàn)利用了氧化還原反應(yīng)的是( )
選項(xiàng) 待檢驗(yàn)離子 檢驗(yàn)試劑 A Fe3+ KSCN溶液 B I- Cl2、淀粉溶液 C SO42- 稀鹽酸、氯化鋇溶液 D NH4+ 濃NaOH溶液濕潤(rùn)的紅色石蕊試紙 A.A B.B C.C D.D 組卷:180引用:6難度:0.7 -
4.現(xiàn)有DX、H2Y和H2Z三種酸,各酸及其鹽之間不發(fā)生氧化還原反應(yīng),它們的電離常數(shù)如下表所示。
下列說(shuō)法正確的是( )酸 電離常數(shù)(25℃) HX K2═10-9.2 H2Y K21═10-6.4Ka2═10-10.3 H2Z Ka1═10-1.9Ka2═10-7.2 A.在水溶液中結(jié)合H+的能力:Y2-<Z2- B.NaHY與NaHZ兩溶液混合反應(yīng)的離子方程式為:HY-+HZ-═Y2-+H2Z C.Na2Y溶液與過(guò)量HX反應(yīng)的離子方程式:HX+Y2-═X-+HY- D.25℃時(shí),濃度均為0.1mol?L-1的H2Y和H2Z溶液的pH:H2Y<H2Z 組卷:37引用:1難度:0.6 -
5.電導(dǎo)率可用于衡量電解質(zhì)溶液導(dǎo)電能力的大小。室溫下,用0.100mol?L-1NH3?H2O滴定10mL濃度均為0.100mol?L-1HCl和CH3COOH的混合液,電導(dǎo)率曲線如圖所示,下列說(shuō)法正確的是( )

A.①溶液中c(H+)為0.200mol?L-1 B.溶液溫度高低為①>③>② C.③點(diǎn)溶液中有c(Cl-)>c(CH3COO-) D.③點(diǎn)后因離子數(shù)目減少使電導(dǎo)率略降低 組卷:84引用:4難度:0.6 -
6.在鹵水精制中,納濾膜對(duì)Ca2+、Mg2+有很高的脫除率。一種網(wǎng)狀結(jié)構(gòu)的納濾膜J的合成路線如圖(圖中
 表示鏈延長(zhǎng))。已知:
表示鏈延長(zhǎng))。已知: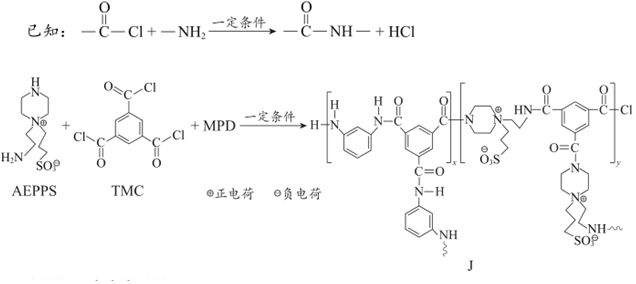
下列說(shuō)法不正確的是( )A.合成J的反應(yīng)為縮聚反應(yīng) B.MPD的核磁共振氫譜有3組峰 C.J具有網(wǎng)狀結(jié)構(gòu)與單體TMC的結(jié)構(gòu)有關(guān) D.J有親水性可能與其存在正負(fù)離子對(duì)有關(guān) 組卷:85引用:5難度:0.5
二、填空題(5道大題,共58分)
-
18.鉛精礦可用于冶煉金屬鉛,其主要成分為PbS。
Ⅰ.火法煉鉛將鉛精礦在空氣中焙燒,生成PbO和SO2。
(1)用鉛精礦火法煉鉛的反應(yīng)的化學(xué)方程式為。
(2)火法煉鉛的廢氣中含低濃度SO2,可將廢氣通入過(guò)量氨水中進(jìn)行處理,反應(yīng)的離子方程式為。
Ⅱ.濕法煉鉛在制備金屬鉛的同時(shí),還可制得硫磺,相對(duì)于火法煉鉛更為環(huán)保。濕法煉鉛的工藝流程如圖:
已知:①不同溫度下PbCh2的溶解度如下表所示。
②PbCl2為能溶于水的弱電解質(zhì),在Cl-濃度較大的溶液中,存在平衡:PbCl2(aq)+2Cl-(aq)?溫度(℃) 20 40 60 80 100 溶解度(g) 1.00 1.42 1.94 2.88 3.20 (aq)PbCl2-4
(3)浸取液中FeCl3的作用是。
(4)操作a為加適量水稀釋并冷卻,該操作有利于濾液1中PbCl2的析出,分析可能的原因是。
(5)將溶液3和濾液2分別置于如圖所示電解裝置的兩個(gè)極室中,可制取金屬鉛并使浸取液中的FeCl3再生。
①溶液3應(yīng)置于(填“陰極室”或“陽(yáng)極室”)中。
②簡(jiǎn)述濾液2電解后再生為FeCl3的原理:。
③若鉛精礦的質(zhì)量為a g,鉛浸出率為b,當(dāng)電解池中通過(guò)c mol電子時(shí),金屬鉛全部析出,鉛精礦中PbS的質(zhì)量分?jǐn)?shù)的計(jì)算式為。組卷:30引用:2難度:0.5 -
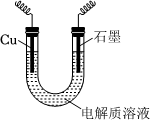 19.某小組欲用電解的方法獲得Cu(OH)2,實(shí)驗(yàn)裝置如圖(電源裝置略去).
19.某小組欲用電解的方法獲得Cu(OH)2,實(shí)驗(yàn)裝置如圖(電源裝置略去).
(1)分別以NaOH溶液和NaCl溶液為電解質(zhì)溶液制備Cu(OH)2.
資料:實(shí)驗(yàn) 電解質(zhì)溶液 現(xiàn)象 銅電極附近 石墨電極 Ⅰ NaOH溶液 出現(xiàn)渾濁,渾濁的顏色由黃色很快變?yōu)榇u紅色 產(chǎn)生無(wú)色氣泡 Ⅱ NaCl溶液 出現(xiàn)白色渾濁,渾濁向下擴(kuò)散,一段時(shí)間后,下端部分白色沉淀變?yōu)榇u紅色 產(chǎn)生無(wú)色氣泡
ⅰ.CuOH是黃色、易分解的難溶固體,CuCl1是白色的難溶固體
ⅱ.氧化反應(yīng)中,增大反應(yīng)物濃度或降低生成物濃度,氧化反應(yīng)越易發(fā)生
①Ⅰ和Ⅱ中Cu作極(填“陽(yáng)”或“陰”).
②Ⅱ中石墨電極產(chǎn)生氣體的電極反應(yīng)式為.
③Ⅱ中白色沉淀變?yōu)榇u紅色的離子方程式是.根據(jù)Ⅱ中現(xiàn)象,甲認(rèn)為電解質(zhì)溶液中存在Cl-,有利于Cu被氧化為一價(jià)銅化合物,理由是.
(2)探究Ⅰ和Ⅱ中未生成Cu(OH)2的原因,繼續(xù)實(shí)驗(yàn).
資料:堿式硫酸銅[xCu(OH)2?yCuSO4]難溶于水,可溶于酸和氨水.常溫時(shí)堿式硫酸銅[xCu(OH)2?CuSO4]的溶解度比Cu(OH)2的大實(shí)驗(yàn) 電解質(zhì)溶液 現(xiàn)象 Ⅲ Na2SO4溶液 銅電極附近溶液呈藍(lán)色,一段時(shí)間后,U型管下端出現(xiàn)藍(lán)綠色沉淀
①經(jīng)檢驗(yàn),藍(lán)綠色沉淀中還含有少量堿式硫酸銅,檢驗(yàn)含有堿式碳酸銅的實(shí)驗(yàn)方案是.
②小組認(rèn)為適當(dāng)增大c(OH-)可以減少堿式硫酸銅的生成,理由是.
(3)進(jìn)一步改進(jìn)方案,進(jìn)行如下實(shí)驗(yàn).
Ⅳ中出現(xiàn)深藍(lán)色說(shuō)明電解生成了實(shí)驗(yàn) 電解質(zhì)溶液 現(xiàn)象 Ⅳ Na2SO4和的混合液(pH═9) 銅電極附近溶液呈深藍(lán)色 Ⅴ Na2SO4和NaOH的混合液(pH═9) 銅電極附近出現(xiàn)藍(lán)色渾濁,一段時(shí)間后,U型管底部出現(xiàn)藍(lán)色沉淀 離子.
經(jīng)檢驗(yàn),Ⅴ中最終生成了Cu(OH)2.
(4)綜合上述實(shí)驗(yàn),電解法制備Cu(OH)2要考慮的因素有.組卷:146引用:2難度:0.2


