2021年陜西省咸陽市高考化學模擬試卷(一)
發(fā)布:2024/12/4 15:0:1
一、選擇題(本題共16小題,每小題3分,共48分。在每小題給出的四個選項中,只有一項是符合題目要求的)
-
1.化學與生產、生活及環(huán)境密切相關,下列說法錯誤的是( )
A.純堿去除油污時發(fā)生了水解反應 B.火法煉銅的礦石原料主要含Cu2S C.煤經過氣化和液化等化學變化可轉化為清潔能源 D.體積分數為95%的酒精溶液可以更有效地滅活新型冠狀病毒 組卷:51引用:1難度:0.7 -
2.下列對化學用語的描述中正確的是( )
A.水晶的分子式為:SiO2 B.用于考古斷代的一種核素的符號為: C136C.次氯酸的結構式為:H-O-Cl D.氯化銨的電子式為: 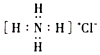 組卷:55引用:1難度:0.7
組卷:55引用:1難度:0.7 -
3.勤勞智慧的中國人民探索未知世界的過程凝結在傳統文化之中。下列說法從化學視角理解,錯誤的是( )
A 日照澄洲江霧開,淘金女伴滿江隈 詩句中描述了丁達爾現象 B 高奴出脂水,頗似淳漆,燃之如麻 句中的“脂水”是指油脂 C 水銀乃至陰毒物,因火煅丹砂而出 詩句中涉及氧化還原反應 D 百寶都從海舶來,玻璃大鏡比門排 玻璃的主要成分是硅酸鹽 A.A B.B C.C D.D 組卷:73引用:1難度:0.8 -
4.常溫下,下列各組離子在指定溶液中一定能大量共存的是( )
A.澄清透明溶液中:Cu2+、NH4+、SO42-、Cl- B.pH=7的溶液中:Fe3+、Na+、Cl、NO3- C.能使甲基橙變黃的溶液中:Mg2+、Ba2+、NO3-、HCO3- D.能溶解Al2O3的溶液中:K+、Fe2+、HS-、CH3COO- 組卷:74引用:1難度:0.8 -
5.離子方程式能表示化學反應的本質。下列離子方程式書寫正確的是( )
A.用小蘇打治療胃酸(HCl)過多:CO32-+2H+═CO2↑+H2O B.將Fe(OH)3固體溶于HI溶液:Fe(OH)3+3H+═Fe3++3H2O C.重鉻酸鉀固體溶于蒸餾水:Cr2O72-+H2O?2CrO42-+2H+ D.用Na2SO3溶液吸收少量Cl2:SO32-+Cl2+H2O═2H++2Cl-+SO42- 組卷:47引用:1難度:0.7 -
6.某學生以鐵絲和Cl2為原料進行如圖所示三個實驗。從分類的角度來分析,下列說法正確的是( )
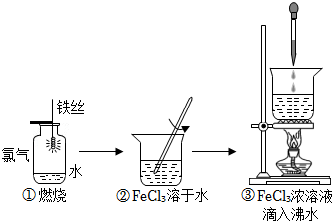
A.實驗①、③制得的物質均為純凈物 B.實驗②、③均未發(fā)生氧化還原反應 C.實驗①、②、③均發(fā)生了放熱反應 D.實驗①、②所涉及的物質均為電解質 組卷:96引用:2難度:0.5 -
7.某實驗小組用MgBr2稀溶液模擬從海水中制取無水氯化鎂和溴單質,實驗流程如圖所示,下列說法錯誤的是( )
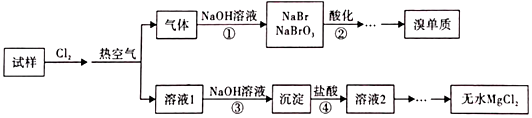
A.可用Na2SO3溶液代替步驟①中的NaOH溶液 B.步驟②發(fā)生反應的離子方程式為:5Br-+BrO3-+6H+═3Br2+3H2O C.步驟③包含過濾、洗滌等操作 D.溶液1和溶液2的主要成分相同,但濃度不同 組卷:35引用:1難度:0.4
二、非選擇題(木題共5小題,共52分)
-
20.三氯氧磷(POCl3)可用作有機合成的氯化劑和催化劑。
已知:①KSCN+AgNO3═AgSCN↓+KNO3;
②Ksp(AgCl)>Ksp(AgSCN);
③磷酸銀可溶于硝酸;
④PCl3和POCl3的相關信息如表。
實驗室制取POCl3并測定產品純度的實驗過程如下:物質 熔點/℃ 沸點/℃ 相對分子質量 性質 PCl3 -111.8 74.2 137.5 均為無色液體,遇水均劇烈水解,生成含氧酸和氯化氫,兩者互溶。 POCl3 2.0 105.3 153.5
Ⅰ.制備POCl3可用氧氣氧化液態(tài)PCl3的方法。實驗裝置(加熱及夾持裝置省略):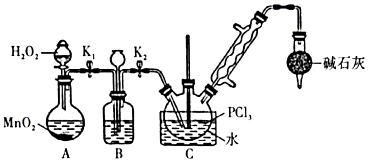
(1)裝置C中盛裝PCl3的儀器名稱為;氧氣氧化PCl3的化學方程式為。
(2)儀器組裝完成后,檢查裝置A氣密性的方法是。
(3)裝置B的作用有、。(回答兩點)
(4)裝置C的反應溫度控制在60~65℃之間,原因是。
Ⅱ.測定產品中POCl3純度的實驗步驟:
①實驗Ⅰ結束后,待反應器中液體冷卻到室溫,準確稱取1.3300g的POCl3粗產品(雜質不含氯元素),置于盛有50.00mL蒸餾水的燒杯中搖動至完全水解,將水解液配成100.00mL溶液;
②取10.00mL溶液于錐形瓶中,加入30.00mL 0.1200mol?L-1AgNO3標準溶液;
③加入少量硝基苯,用力搖動,靜置;
④加入指示劑,用0.1000mol?L-1KSCN溶液滴定過量的AgNO3溶液,到達終點時共用去12.00mL KSCN溶液。
(5)滴定過程中選擇的指示劑為溶液。
(6)步驟③的目的是。
(7)測得產品中POCl3的純度為%。組卷:68引用:1難度:0.3 -
21.鋰離子電池已被人們廣泛使用,對其高效回收利用具有重要意義。某鋰離子電池正極是涂覆在鋁箔上的活性物質LiCoO2.利用該種廢舊鋰離子電池正極材料制備Co3O4的工藝流程如圖1:
已知:①CoC2O4?2H2O微溶于水,它的溶解度隨溫度升高而逐漸增大,且能與過量的C2O42-離子生成Co(C2O4)n2(n-1)-而溶解。
②浸出液A含有大量Co2+、Li+及少量Fe3+、Al3+、Cu2+金屬離子。
(1)在過程①中,用NaOH溶液溶解鋁箔時離子反應方程式為。
(2)在過程②中,難溶于水的LiCoO2轉化為Co2+的離子反應方程式為。
此過程中也可用濃鹽酸代替H2SO4和H2O2的混合溶液,但缺點是:除了濃鹽酸具有揮發(fā)性,利用率降低以外,更為主要的是。
(3)在過程③中,將浸出液A適當稀釋加入堿后,不同pH下金屬離子的去除效果如圖2所示。該過程加堿調節(jié)pH在5.5~6.0的理由是。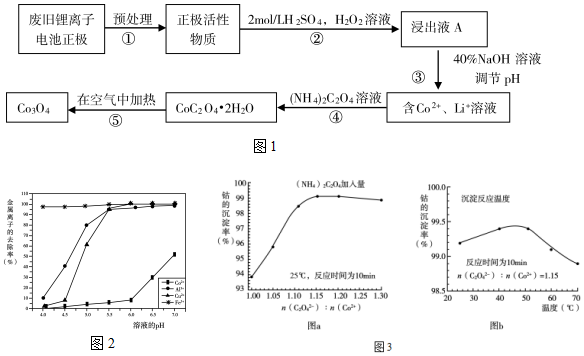
(4)在過程④中,(NH4)2C2O4的加入量(圖a)、沉淀反應的溫度(圖b)與鈷的沉淀率關系如圖3所示:
①用化學用語和適當的文字說明:隨n(C2O42-):n(Co2+)比值的增加,鈷的沉淀率先逐漸增大后又逐漸減小的原因。
②沉淀反應時間為10min,溫度在40~50℃以下時,隨溫度升高而鈷的沉淀率升高的可能原因是。
(5)在過程⑤中,在空氣中加熱到290~320℃,CoC2O4?2H2O轉化為Co3O4的化學反應方程式為。組卷:148引用:2難度:0.3


