2018年北京市人大附中高考化學一模試卷
發布:2024/11/23 17:30:1
一、選擇題(共7小題,每小題6分,滿分42分)
-
1.下列關于物質的組成、性質和用途的說法中,錯誤的是( )
A B C D 聚乙烯盒 
帶玻璃塞的試劑瓶 
鐵罐車 
鋁制飯盒 
可用于盛裝食品 可用于盛放碳酸鈉溶液 可用于運輸濃硫酸 不宜長時間存放酸性或堿性的食物 A.A B.B C.C D.D 組卷:30引用:2難度:0.8 -
2.硒(Se)是人體健康必需的一種微量元素。已知Se的原子結構示意圖為:
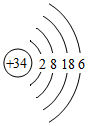 下列說法不正確的是( )
下列說法不正確的是( )A.該原子的質量數為34 B.該元素處于第四周期第ⅥA族 C.SeO2既有氧化性又有還原性 D.酸性:HClO4>H2SeO4 組卷:114引用:7難度:0.9 -
3.合成導電高分子材料PPV的反應:

下列說法正確的是( )A.合成PPV的反應為加聚反應 B.PPV與聚苯乙烯具有相同的重復結構單元 C.  和苯乙烯互為同系物
和苯乙烯互為同系物D.通過質譜法測定PPV的平均相對分子質量,可得其聚合度 組卷:1534引用:36難度:0.8
二、解答題(共4小題,滿分58分)
-
10.利用酸解法制鈦白粉產生的廢液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生產鐵紅和補血劑乳酸亞鐵。其生產步驟如圖。
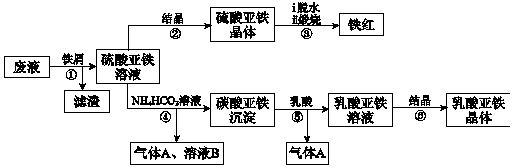
已知:TiOSO4可溶于水,在水中可以電離為TiO2+和SO42-,TiOSO4水解成TiO2?xH2O沉淀為可逆反應;乳酸結構簡式為CH3CH(OH)COOH。
請回答:
(1)步驟①中分離硫酸亞鐵溶液和濾渣的操作是。
(2)加入鐵屑的目的一是還原少量Fe2(SO4)3;二是使少量TiOSO4轉化為TiO2?xH2O濾渣,用平衡移動的原理解釋得到濾渣的原因。
(3)硫酸亞鐵在空氣中煅燒生成鐵紅和三氧化硫,該反應中氧化劑和還原劑的物質的量之比為。
(4)用離子方程式解釋步驟⑤中加乳酸能得到乳酸亞鐵的原因。
(5)步驟④的離子方程式是。
(6)步驟⑥必須控制一定的真空度,原因是有利于蒸發水以及。
(7)為測定步驟②中所得晶體中FeSO4?7H2O的質量分數,取晶體樣品a g,溶于稀硫酸配成100.00mL溶液,取出20.00mL溶液,用KMnO4溶液滴定(雜質與KMnO4不反應)。若消耗0.1000mol?L-1 KMnO4溶液20.00 mL,所得晶體中FeSO4?7H2O的質量分數為。(用a表示)組卷:20引用:1難度:0.5 -
11.某學生探究如下實驗(A):
(1)使淀粉變藍的物質是實驗A 條件 現象
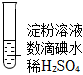
加熱 ⅰ.加熱后藍色褪去
ⅱ.冷卻過程中,溶液恢復藍色
ⅲ.一段時間后,藍色重又褪去.
(2)分析現象ⅰ、ⅱ認為:在酸性條件下,加熱促進淀粉水解,冷卻后平衡逆向移動.設計實驗如圖1,“現象a”證實該分析不合理:“現象a”是.
(3)再次分析:加熱后單質碘發生了變化,實驗如下:
Ⅰ:取少量碘水,加熱至褪色,用淀粉溶液檢驗揮發出的物質,變藍.
Ⅱ:向褪色后的溶液中滴加淀粉溶液,冷卻過程中一直未變藍;加入稀H2SO4,瞬間變藍.
對步驟Ⅱ中稀H2SO4的作用,結合離子方程式,提出一種合理的解釋.
(4)探究碘水褪色后溶液的成分:
實驗1:測得溶液的pH≈5
實驗2:取褪色后的溶液,完成如圖2實驗:
①產生黃色沉淀的離子方程式是.
②Ag2O的作用是.
③依據上述實驗,推測濾液中含有的物質(或離子)可能是.
(5)結合化學反應速率解釋實驗A中現象ⅰ、現象ⅲ藍色褪去的原因.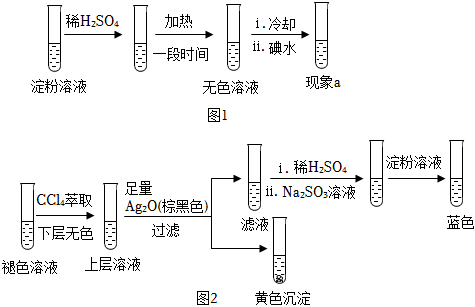 組卷:265引用:9難度:0.1
組卷:265引用:9難度:0.1


