2021-2022學年云南省昆明市官渡一中高二(上)期中化學試卷
發布:2024/11/30 12:0:2
一、選擇題(本大題共21小題,每小題2分,共42分。每個小題只有一個選項符合題意)
-
1.化學與人類生產、生活密切相關,下列敘述中正確的是( )
A.京東方生產的可折疊柔性屏中的靈魂材料——納米銀與硝酸不會發生化學反應 B.“超輕海綿”使用的石墨烯是新型有機高分子材料 C.硅是制作光導纖維的主要材料 D.2022年北京冬奧會吉祥物“冰墩墩”使用的聚乙烯屬于高分子材料 組卷:0引用:1難度:0.6 -
2.下列有關鈉及其化合物的敘述中不正確的是( )
A.除去碳酸鈉固體中混有的碳酸氫鈉,可將固體加熱 B.可用CaCl2溶液鑒別NaHCO3和Na2CO3兩種溶液 C.金屬鈉著火時,可用水來滅火 D.Na、Na2O、Na2O2、NaOH長期放置在空氣中,最終都將變為Na2CO3 組卷:78引用:5難度:0.8 -
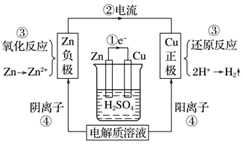 3.如圖是某同學學習原電池后整理的學習筆記,錯誤的是( )
3.如圖是某同學學習原電池后整理的學習筆記,錯誤的是( )A.①電子流動方向 B.②電流方向 C.③電極反應 D.④溶液中離子移動方向 組卷:41引用:5難度:0.7 -
4.下列反應中,屬于取代反應的是( )
A.甲烷在空氣中燃燒 B.乙烯通入到溴的四氯化碳溶液,溶液褪色 C.乙烯制備聚乙烯 D.用光照射甲烷和氯氣的混合氣體 組卷:13引用:1難度:0.8 -
5.下列解釋事實的離子方程式中,不正確的是( )
A.向FeCl2溶液中通入氯氣,溶液變為黃色:2Fe2++Cl2═2Fe3++2Cl- B.向銅粉中滴加稀硝酸,產生氣體:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O C.向CuSO4溶液中滴加NaOH溶液,產生藍色沉淀:Cu2++2OH-═Cu(OH)2↓ D.自來水中通入Cl2可以殺菌消毒:Cl2+H2O?H++Cl-+HClO 組卷:83引用:2難度:0.5 -
6.下列實驗現象與結論均正確的是( )
選項 實驗操作 實驗現象 實驗結論 A 向未知液中滴加氯水,再滴加KSCN溶液 溶液呈紅色 未知液中一定含有Fe2+ B 向未知溶液中,先加入氫氧化鈉溶液,加熱,用潤濕的紅色石蕊試紙靠近 試紙變藍 無色溶液中含有NH4+ C 向某溶液中加入氯化鋇溶液 有白色沉淀
生成該溶液中一定含有SO42- D 將銀白色的金屬鈉放置在空氣中 鈉表面很快變暗 金屬鈉具有強氧化性 A.A B.B C.C D.D 組卷:23引用:2難度:0.5 -
7.設NA為阿伏加德羅常數的值。下列說法正確的是( )
A.標準狀況下,1molSO3的體積為22.4L B.0.2molCu與含0.4molH2SO4的濃硫酸在加熱的條件下反應時,生成的SO2在標準狀況下的體積為4.48L C.1molCu與足量的S充分反應,轉移的電子數為2NA D.0.5molCu與足量濃硝酸反應時,轉移的電子數為NA 組卷:21引用:6難度:0.6 -
8.下列有關說法中正確的是( )
A.2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g)在低溫下能自發進行,則該反應的ΔH>0 B.NH4Cl(s)=NH3(g)+HCl(g)室溫下不能自發進行,說明該反應的ΔH<0 C.若ΔH>0,ΔS<0,化學反應在任何溫度下都不能自發進行 D.加入合適的催化劑能降低反應活化能,從而改變反應的焓變 組卷:17引用:3難度:0.6
二、填空題(本題包含5個小題,共58分)
-
25.實驗是化學研究的一種重要手段,請完成以下實驗的探究與分析。
(1)中和熱測定實驗的關鍵是準確配制一定物質的量濃度的溶液,量熱器盡量做到絕熱;在量熱過程中盡量避免熱量的散失,準確測量出反應前后溶液溫度的變化。
請回答下列問題:
①測定中和熱時需要用到的玻璃儀器有大燒杯、小燒杯、量筒、溫度計和在大、小燒杯之間填滿碎泡沫(或碎紙條)的作用是。
②該實驗常用0.50mol/L的鹽酸和0.55mol/L的NaOH溶液各50mL進行反應,NaOH的濃度大于HCl的濃度,原因是。
③若上述鹽酸、NaOH溶液的密度都近似為1g/mL,中和后生成的溶液的比熱容c=4.18J/(g?℃),混合溶液的起始溫度為t1℃,最高溫度為t2℃,則中和熱ΔH=kJ/mol(填表達式,下同)。
(2)某研究性學習小組利用H2C2O4溶液和酸性KMnO4溶液之間的反應來探究“外界條件改變對化學反應速率的影響”,實驗如下:(不考慮溶液混合所引起的體積縮小)
①通過實驗A、B,可探究出濃度的改變對反應速率的影響,其中V1=實驗序號 實驗溫度/K 參加反應的物質 溶液顏色褪至無色時所需時間/s KMnO4溶液(含硫酸) H2C2O4溶液 H2O V/mL c/mol?L-1 V/mL c/mol?L-1 V/mL A 293 2 0.02 4 0.1 0 6 B T1 2 0.02 3 0.1 V1 8 C 313 2 0.02 V2 0.1 1 t1 ;T1=。通過實驗可探究出溫度變化對化學反應速率的影響。
②C組實驗中溶液褪色時間t1(填“>”或“<”)8s,C組實驗的反應速率v(KMnO4)=。(用含有t1的式子表示)組卷:15引用:1難度:0.6 -
26.氮是地球上含量豐富的一種元素,氮及其化合物在工農業生產、生活中有著重要作用,合成氨工業在國民生產中有重要意義。以下是關于合成氨的有關問題,請回答:
(1)若在一容積為2L的密閉容器中加入0.2mol的N2和0.6mol的H2在一定條件下發生反應:N2(g)+3H2(g)?2NH3(g)ΔH<0,若在5分鐘時反應達到平衡,此時測得NH3的物質的量為0.2mol,則前5分鐘平均反應速率v(N2)=。平衡時H2的轉化率為%。
(2)平衡后,若提高H2的轉化率,可以采取的措施有。
A.加了催化劑
B.增大容器體積
C.降低反應體系的溫度
D.加入一定量N2
(3)若在0.5L的密閉容器中,一定量的氮氣和氫氣進行如下反應:N2(g)+3 H2(g)?2NH3(g)ΔH<0,其化學平衡常數K與溫度T的關系如表所示:
請完成下列問題:T/℃ 200 300 400 K K1 K2 0.5
①試比較K1、K2的大小,K1K2(填“<”“>”或“=”)。
②400℃時,反應2NH3(g)?N2(g)+3H2(g)的化學平衡常數為。當測得NH3、N2和H2物質的量分別為3mol、2mol和1mol時,則該反應的v(N2)正v(N2)逆(填“<”“>”或“=”)。
③下列可用于判斷N2(g)+3 H2(g)?2NH3(g)反應達到平衡狀態的依據是。
A.容器中氣體壓強不再變化
B.容器中氣體的密度不再變化
C.容器中氣體平均摩爾質量不再變化
D.3v(N2)正=2v(N2)逆組卷:15引用:1難度:0.7


