2021年天津市十二區縣重點學校高考化學聯考試卷(一)
發布:2024/12/15 16:30:6
一、選擇題(共12小題,每小題3分,滿分36分)
-
1.下列貢獻與中國科學家有關的是( )
A.發現青蒿素,合成結晶牛胰島素 B.創立侯氏制堿法,提出元素周期律 C.總結出平衡移動原理,發現青蒿素 D.創立侯氏制堿法,發明合成氨技術 組卷:52引用:2難度:0.8 -
2.下列有關物質用途的說法中,不正確的是( )
A.三氧化二鐵常用作紅色油漆和涂料 B.強化木地板表面的氧化鋁具有耐磨與阻燃的作用 C.我國提出網絡強國戰略,光纜線路總長超過三千萬公里,光纜的主要成分是晶體硅 D.過氧化鈉可用于呼吸面具或潛水艇中作為氧氣的來源 組卷:68引用:2難度:0.7 -
3.下列說法正確的是( )
A.制成集成電路板的酚醛樹脂可導電 B.雞蛋清中滴加1%的NH4Cl溶液產生的沉淀能重新溶于水 C.油脂都可以使溴的四氯化碳溶液褪色 D.淀粉和纖維素互為同分異構體 組卷:129引用:2難度:0.9 -
4.下列敘述正確的是( )
A.用稀硫酸清除暖瓶水垢(主要成分碳酸鈣) B.用氨水清除試管壁附著的銀鏡 C.用碳酸鈉溶液清除鋼鐵制品表面的油污 D.用氫氧化鈉溶液清洗沾在皮膚上的苯酚 組卷:59引用:2難度:0.6 -
5.下列指定反應的離子方程式正確的是( )
A.向碳酸鈉溶液中通入少量SO2:CO32-+SO2+H2O═HSO3-+HCO3- B.Fe(OH)3和HI溶液的反應:Fe(OH)3+3H+═Fe3++3H2O C.用惰性電極電解MgCl2溶液:2H2O+2Cl- 2OH-+H2↑+Cl2↑通電D.向Ba(OH)2溶液中滴入NaHSO4溶液至Ba2+恰好完全沉淀:H++SO42-+Ba2++OH-═BaSO4↓+H2O 組卷:134引用:2難度:0.5
二、解答題(共4小題,滿分0分)
-
15.(NH4)2Cr2O7用于有機合成催化劑,媒染劑,顯影液等。某化學興趣小組對(NH4)2Cr2O7的部分性質及組成進行探究。已知:Cr2O72-(橙色)+H2O?2Cr2O42-(黃色)+2H+。回答下列問題:
(1)在試管中加入少量(NH4)2Cr2O7固體,滴加足量濃KOH溶液,振蕩、微熱,觀察到的主要現象是固體溶解、、。
(2)為探究(NH4)2Cr2O7(摩爾質量252g/mol)的分解產物,按圖連接好裝置,在A中加入2.52g樣品進行實驗。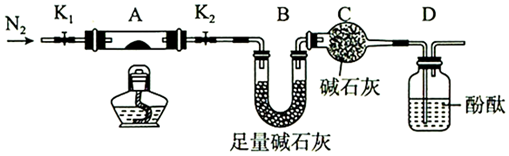
①C的作用是。
②實驗操作步驟:a.打開K1和K2,緩緩通入N2→b.點燃酒精燈,加熱→c.熄滅酒精燈→d.→e.關閉K1和K2→f.稱量A和B,則d的操作為。
③加熱A至恒重,觀察到D中溶液不變色,同時測得A、B中質量變化分別為1.00g、0.72g,寫出重鉻酸銨加熱分解反應的化學方程式。
(3)實驗室常用甲醛法測定含(NH4)2Cr2O7的樣品中氮的質量分數,其反應原理為:2Ba2++Cr2O72-+H2O═2BaCrO4+2H+;4NH4++6HCHO═3H++6H2O+(CH2)6N4H+;(CH2)6N4H+?(CH2)6N4+H+,K=7×10-6,然后用NaOH標準溶液滴定反應生成的酸。
實驗步驟:
Ⅰ.稱取樣品ag,配成250mL溶液。
Ⅱ.量取25.00mL樣品溶液,用氯化鋇溶液使Cr2O72-完全沉淀后,加入10mL 20%的中性甲醛溶液,搖勻、靜置5min。
Ⅲ.以酚酞作指示劑,用cmol?L-1標準NaOH溶液滴定,記錄數據。
Ⅳ.重復步驟Ⅱ、Ⅲ2~3次,處理數據。
①滴定終點的顏色變化。
②滴定操作使用的玻璃儀器主要有。
③步驟Ⅲ發生反應的離子方程式是。
④若實驗平均消耗NaOH溶液的體積為bmL,該樣品中氮的質量分數的計算式為。(用含a、b、c式子表示,需要化簡)
⑤下列情況會導致測定結果偏低的是。(填序號)
a.若實驗中使用的甲醛常混有微量甲酸
b.若步驟Ⅱ沒有靜置5min
c.若滴定終點讀數時,俯視標準液液面組卷:130引用:4難度:0.5 -
16.氫氣是一種理想的綠色能源。利用生物質發酵得到的乙醇制取氫氣,具有良好的應用前景。乙醇和水蒸氣重整制氫的部分反應過程如圖1所示。
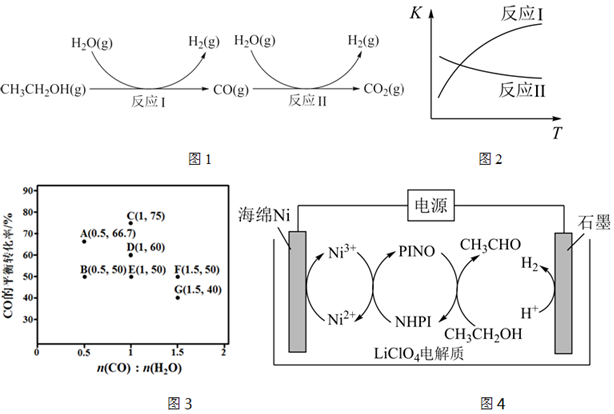
已知:反應Ⅰ和反應Ⅱ的平衡常數隨溫度變化曲線如圖2所示。
(1)反應Ⅰ中,1mol CH3CH2OH(g)參與反應后的熱量變化是236kJ。
①反應Ⅰ的熱化學方程式是。
②反應Ⅰ在較高溫度下能夠自發進行的原因是。
③已知絕熱恒壓下,對于反應Ⅰ處于化學平衡狀態時的描述,正確的是。(填字母)
a.CO的含量保持不變
b.容器中壓強保持不變
c.2v正(CO)=v逆(CH3CH2OH)
d.體系的溫度保持不變
(2)反應Ⅱ中,在進氣比[n(CO):n(H2O)]不同時,測得相應的CO的平衡轉化率如圖3。(各點對應的反應溫度可能相同,也可能不同)。
①圖中D、E兩點對應的反應溫度分別為TD和TE,判斷:TDTE。(填“<”、“=”或“>”)
②已知CO和H2O的起始濃度總和為5mol/L,在G點的投料比下,該溫度下反應平衡常數的值為。
③當不同的進氣比達到相同的CO平衡轉化率時,對應的反應溫度和進氣比的關系是。
(3)在N-羥基鄰苯二甲酰亞胺(NHPI)介質中,可實現乙醇向乙醛的轉化,原理如圖4。
①該電池的陽極是。
②該電解池的總反應為。組卷:97引用:2難度:0.5


