2022-2023學年江西省南昌市蓮塘一中高二(上)期中化學試卷
發(fā)布:2024/10/11 11:0:2
一、選擇題(本題共10個小題,每小題3分,共30分,每小題只有一個選項符合題意)
-
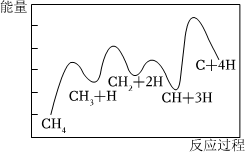 1.一定條件下,CH4分解形成碳的反應歷程如圖所示。下列有關說法不正確的是( )
1.一定條件下,CH4分解形成碳的反應歷程如圖所示。下列有關說法不正確的是( )A.該反應為吸熱反應 B.該反應歷程共分3步進行 C.第3步的正反應活化能最小 D.第二步反應的ΔH2大于第三步反應的ΔH3 組卷:1引用:3難度:0.6 -
2.下列對熵的理解錯誤的是( )
A.等質(zhì)量的同種物質(zhì)氣態(tài)時熵值最大,固態(tài)時熵值最小 B.體系越有序,熵值越小;越混亂,熵值越大 C.與外界隔離的體系,自發(fā)過程將導致體系的熵增大 D.25℃、1.01×105Pa時,2N2O5(g)═4NO2(g)+O2(g)是熵減反應 組卷:8引用:3難度:0.5 -
3.H2與O2發(fā)生反應的過程用模型圖示意如下(“—”表示化學鍵),下列說法正確的是( )
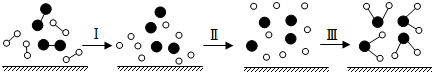
A.該反應過程中所有舊化學鍵都斷裂,且形成了新化學鍵 B.過程Ⅰ是放熱過程 C.過程Ⅲ一定是吸熱過程 D.該反應的能量轉(zhuǎn)化形式只能以熱能的形式進行 組卷:4引用:3難度:0.7 -
4.氧化亞銅常用于制船底防污漆,用CuO與Cu高溫燒結(jié)可制取Cu2O,已知反應:
2Cu(s)+O2(g)=2CuO(s) ΔH=-325kJ?mol-1
2Cu2O(s)+O2(g)=4CuO(s) ΔH=-281kJ?mol-1
則CuO(s)+Cu(s)=Cu2O(s)的ΔH等于( )A.+11kJ?mol-1 B.-11kJ?mol-1 C.+22kJ?mol-1 D.-22kJ?mol-1 組卷:7引用:3難度:0.7 -
5.下列關于熱化學反應的描述正確的是( )
A.葡萄糖的燃燒熱是2800kJ?mol-1,則 O(l)ΔH=+1400kJ?mol-112C6H12O6(s)+3O2(g)=3CO2(g)+3H2B.燃料電池中將甲醇蒸氣轉(zhuǎn)化為氫氣的熱化學方程式是CH3OH(g)+ (g)ΔH=-192.9kJ?mol-1,則CH3OH(g)的燃燒熱為192.9kJ?mol-112O2(g)=CO2(g)+2H2C.已知2H2O(g)=2H2(g)+O2(g)ΔH=+484kJ?mol-1,則H2(g)燃燒熱是242kJ/mol D.已知H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3kJmol-1,則H2SO4(aq)和Ba(OH)2(aq)反應生成2molH2O(l)時的反應熱ΔH<2×(-57.3)kJ?mol-1 組卷:4引用:3難度:0.7 -
6.反應4A(s)+3B(g)?2C(g)+D(g),經(jīng)3min,D的濃度增加0.9mol?L-1,下列說法正確的是( )
A.用A表示的反應速率是1.2mol?L-1?min B.在2min末的反應速率,用B表示是0.9mol?L-1?min-1 C.若相同時間內(nèi),分別用B、C表示的反應速率均為0.9mol?L-1?min-1,則這兩段時間內(nèi)反應速率不相等 D.前2min,v正(B)和v逆(C)表示的反應速率的值都是逐漸減小 組卷:20引用:3難度:0.5
三、非選擇題:本題共4小題,共54分。
-
17.Ⅰ.在恒溫、恒容容器中進行反應CO2(g)+4H2(g)?CH4(g)+2H2O(g) ΔH=-252.9kJ?mol-1。
(1)下列不能說明反應達到平衡狀態(tài)的是(填字母)。
A.CO2和H2的轉(zhuǎn)化率之比不再變化
B.混合氣體的平均摩爾質(zhì)量不再變化
C.4υ(H2)正=υ(CH4)逆
D.容器內(nèi)的氣體壓強不再變化
E.混合氣體的平均密度不再變化
Ⅱ.一定條件下,CO2和H2可發(fā)生反應CO2(g)+3H2(g)?CH3OH(g)+H2O(g)ΔH=-53.7kJ?mol-1;恒溫條件下向4L的恒容容器中充入一定量的CO2和H2,發(fā)生上述反應。測得平衡時混合物中CH3OH(g)體積分數(shù)與起始投料比Z[Z=?(CH3OH)]的關系如圖1所示。n(H2)n(CO2)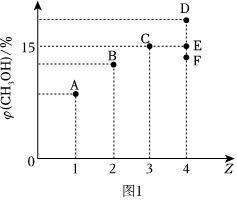
(2)當Z=3時,反應達到平衡時混合氣體總壓強與起始時容器內(nèi)氣體總壓強之比的比值為(結(jié)果保留2位小數(shù))。
(3)當Z=4時,反應達到平衡狀態(tài)后,CH3OH的體積分數(shù)可能是圖1中的點(選填“D”“B”或“F”)。
(4)若充入1molCO2和2.8molH2,圖2中過程Ⅰ、Ⅱ是在兩種不同催化劑作用下建立平衡的過程中CO2的轉(zhuǎn)化率[α(CO2)]隨時間(t)的變化曲線。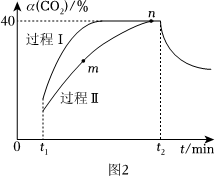
①m點υ(逆)υ(正)(填“>”“<”或“=”)。
②n點時該反應的平衡常數(shù)K=(結(jié)果保留3位有效數(shù)字!)。
③過程Ⅱ反應的活化能過程Ⅰ反應的活化能(填“大于”“小于”或“等于”)。組卷:2引用:2難度:0.5 -
18.T℃時,純水電離的c(OH-)為1×10-6mol/L。該溫度下,如果取0.1mol/LHB溶液與0.1mol/LNaOH溶液等體積混合(忽略混合后溶液體積的變化),測得混合溶液的pH=7。試回答以下問題:
(1)混合溶液的pH=7的原因:(用離子方程式表示)。
(2)混合溶液中由水電離出的c(OH-)(填“>”“<”或“=”)0.1mol/LNaOH溶液中由水電離出的c(OH-)。
(3)求出混合溶液中下列算式的精確計算結(jié)果(填具體數(shù)字):c(Na+)-c(B-)=mol/L,c(OH-)-c(HB)=mol/L。
(4)已知NH4B溶液為中性,又知HB溶液加到Na2CO3溶液中有氣體放出,試推斷(NH4)2CO3溶液中的:c(H+)c(OH-) (填“>”“<”或“=”);將同溫度下等濃度的四種鹽溶液按pH由小到大的順序排列是(填序號)。
A.NH4HCO3
B.NH4B
C.(NH4)2SO4
D.NH4Cl
(5)T℃時,現(xiàn)有pH=x的鹽酸和pH=y的氫氧化鈉溶液,取aL該鹽酸與bL該氫氧化鈉溶液反應,恰好完全中和,若x+y=13,則a:b=(填數(shù)值)。組卷:5引用:2難度:0.5


