2022-2023學年江蘇省常州一中高一(下)期末化學試卷
發布:2024/8/1 8:0:9
一、單選題
-
1.祝融號火星車主體部件采用新型鋁基碳化硅材料制造。鋁基碳化硅材料屬于( )
A.金屬材料 B.無機非金屬材料 C.有機合成材料 D.復合材料 組卷:52引用:5難度:0.7 -
2.黑火藥是中國古代四大發明之一。爆炸反應為2KNO3+3C+S=K2S+3CO2↑+N2↑。下列說法不正確的是( )
A.KNO3含離子鍵和共價鍵 B.K+與S2-具有相同的電子層結構 C.N2的結構式為N≡N D.干冰的晶體類型為共價晶體 組卷:14引用:2難度:0.5 -
3.硫循環在生態系統的諸多領域具有重要意義。在指定條件下,下列選項所示的物質間轉化能實現的是( )
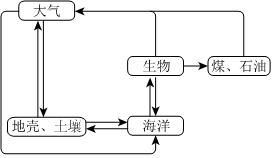
A.工業制酸:FeS2 SO3O2煅燒B.火山噴發:H2S SO2O2高溫C.尾氣吸收:SO2 Na2SO4Na2CO3D.酸雨侵蝕:H2SO4 H2SFe組卷:107引用:3難度:0.8 -
4.下列說法正確的是( )
A.1mol苯分子中含有C=C雙鍵數目為3mol B.1mol乙烯和乙醇的混合物完全燃燒時消耗O2的分子數為3mol C.標準狀況下,11.2LCCl4中含有的共價鍵數目為2mol D.常溫常壓下,17g羥基含有的電子總數為7mol 組卷:51引用:3難度:0.5 -
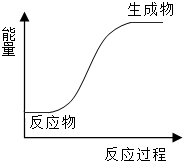 5.下列反應中既是氧化還原反應,能量變化情況又符合如圖的是( )
5.下列反應中既是氧化還原反應,能量變化情況又符合如圖的是( )A.氫氧化鈉與稀鹽酸的反應 B.碳和水蒸氣的反應 C.NH4Cl和Ba(OH)2?8H2O的反應 D.氫氣的燃燒反應 組卷:34引用:4難度:0.5 -
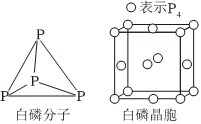 6.氮、磷及其化合物應用廣泛,磷元素有白磷、紅磷等單質,白磷(P4)分子結構及晶胞如圖所示,白磷和紅磷轉化的熱化學方程式為xP4(白磷,s)=4Px(紅磷,s)ΔH<0;實驗室常用CuSO4溶液吸收有毒氣體PH3,生成H3PO4、H2SO4和Cu、P元素可形成多種含氧酸,其中次磷酸(H3PO2)為一元弱酸;磷酸可與鐵反應,在金屬表面生成致密且難溶于水的磷酸鹽膜。下列說法正確的是( )
6.氮、磷及其化合物應用廣泛,磷元素有白磷、紅磷等單質,白磷(P4)分子結構及晶胞如圖所示,白磷和紅磷轉化的熱化學方程式為xP4(白磷,s)=4Px(紅磷,s)ΔH<0;實驗室常用CuSO4溶液吸收有毒氣體PH3,生成H3PO4、H2SO4和Cu、P元素可形成多種含氧酸,其中次磷酸(H3PO2)為一元弱酸;磷酸可與鐵反應,在金屬表面生成致密且難溶于水的磷酸鹽膜。下列說法正確的是( )A.P4分子中的P-P-P鍵角為109°28′ B.白磷和紅磷互為同位素 C.白磷晶體中1個P4分子周圍有8個緊鄰的P4分子 D.白磷和紅磷在O2中充分燃燒生成等量P2O5(s),白磷放出的熱量更多 組卷:12引用:2難度:0.8 -
7.下列化學反應表示正確的是( )
A.用氨水和AlCl3溶液制備Al(OH)3:Al3++3OH-═Al(OH)3↓ B.工業上用足量氨水吸收SO2:NH3?H2O+SO2═NH4HSO3 C.用CuSO4溶液吸收PH3:PH3+4CuSO4+4H2O═4Cu↓+H3PO4+4H2SO4 D.鐵粉與過量稀硝酸:3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O 組卷:70引用:1難度:0.6 -
8.下列物質性質與用途具有對應關系的是( )
A.氮氣為無色氣體,可用作焊接金屬的保護氣 B.硝酸受熱易分解,可用于制NH4NO3 C.液氨汽化時吸收大量熱,可用作制冷劑 D.磷酸難揮發,可用于保護金屬免受腐蝕 組卷:20引用:2難度:0.5
二、填空題
-
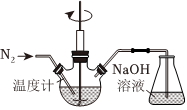 23.利用Zn和KNO3溶液反應模擬地下水的脫硝過程,并探究脫硝原理及相關因素對脫硝速率的影響。模擬過程的實驗裝置如圖所示。
23.利用Zn和KNO3溶液反應模擬地下水的脫硝過程,并探究脫硝原理及相關因素對脫硝速率的影響。模擬過程的實驗裝置如圖所示。
(1)實驗室用稀H2SO4洗滌Zn粒,再用蒸餾水洗滌至接近中性;將KNO3溶液的pH調至2.5。
①用稀H2SO4洗滌Zn粒的目的是。
②向上述KNO3溶液中加入足量洗滌后的Zn粒,寫出Zn與KNO3溶液反應生成的離子方程式NH+4。
③錐形瓶中NaOH溶液的作用是。
(2)某興趣小組進行了如下實驗:取兩套如圖所示裝置,分別加入等體積、等濃度的KNO3溶液;將溶液的pH值調節為2.5,并通入氮氣;將其中一套實驗裝置浸入熱水浴中(或浸入冰水浴中);向三頸瓶中分別加入足量且等質量的同種Zn粒,用離子色譜儀測定相同反應時間時三頸瓶中的濃度。(已知:溶液中的NO-3的物質的量濃度可用離子色譜儀測定)NO-3
①該實驗的目的是。
②該實驗過程中采用了科學探究中一種重要的思想方法是。
(3)反應過程中有生成。為測定反應液中NO-2的含量,取過濾后的濾液100mL,用0.005mol?L-1KMnO4酸性溶液滴定,消耗KMnO4溶液的體積為16.00mL(已知2NO-2+5MnO-4+6H+=2Mn2++5NO-2+3H2O,且在此條件下NO-3不與KMnO4酸性溶液反應)。計算過濾后的濾液中NH+4的物質量濃度NO-2。(寫出計算過程)組卷:28引用:2難度:0.6 -
24.為更好地利用化學變化中的物質變化和能量變化,在化學研究和工業生產中還需要關注化學反應的快慢和進行程度等。實驗發現,Mg+AgCl濾液反應比Mg+H2O反應速率快,研究小組對此實驗現象產生的原因進行了探究。
【提出猜想】
猜想一:Cl-鉆入Mg(OH)2膜形成孔徑,增大了Mg和H2O的接觸面積,加快了Mg+H2O的反應速率,稱作“離子鉆入效應”;
猜想二:在“離子鉆入效應”基礎上,Mg置換Ag+形成許多微小的Mg-Ag原電池,使Mg+H2O反應速率進一步加快。
【實驗設計】
(1)取表面積和質量相同的鎂條(5cm),用濃度分別為1mol/LKCl、0.2mol/LAgNO3、0.2mol/LKNO3溶液,按照下表進行系列實驗,若有沉淀,先將沉淀過濾后,將濾液加入裝Mg條的試管,并觀察Mg條表面實驗現象。
①根據表中信息,補充數據:a=實驗序號 
V(KCl)/mL V(AgNO3)/mL V(KNO3)/mL V(H2O)/mL 實驗現象 1 / / / 5.00 微小氣泡附著 2 4.50 0.50 / / 大量氣泡放出 3 4.50 / / 0.50 少量氣泡放出 4 a / b / 少量氣泡放出 ,b=。
②由實驗1和實驗3對比可知:Cl-有加快Mg+H2O反應速率的作用。
③由實驗和實驗對比可知:Ag+有加快Mg+H2O反應速率的作用。
【實驗結論1】猜想一和猜想二成立。
寫出Ag+的水解離子方程式。
(2)為了進一步證明Mg-Ag原電池能加快Mg+H2O+Cl-體系中Mg+H2O的反應速率,研究小組利用數字化實驗進行了驗證。
【實驗設計】選取實驗2和實驗4兩個實驗方案,采集兩個實驗的pH-時間、溫度-時間變化數據。實驗數據如圖所示: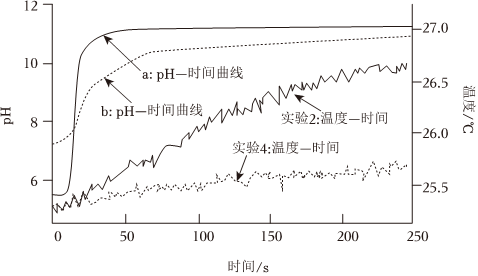
④由初始pH數據可知,曲線(填“a”或“b”)表示實驗2的pH-時間變化曲線,請解釋原因。
⑤在pH=11左右,兩實驗的pH變化都明顯趨于平緩的原因。
⑥對“溫度-時間”曲線分析,在相同反應時間內,(填“實驗2”或“實驗4”)放熱更多,因此速率更快。
【實驗結論2】結合pH-時間、溫度-時間曲線可知,Mg-Ag原電池能加快Mg+H2O+Cl-體系中Mg+H2O的反應速率。組卷:30引用:2難度:0.7


