2023-2024學年北京交大附中高一(上)期中化學練習試卷
發布:2024/10/3 1:0:1
在下列各題的四個選項中,只有一個選項符合題意。(每小題2分,共50分)
-
1.下列變化中,與氧化還原反應無關的是( )
A.食物的腐敗 B.鋼鐵的銹蝕 C.鐘乳石的形成 D.燃料的燃燒 



A.A B.B C.C D.D 組卷:11引用:3難度:0.7 -
 2.2021年5月,我國首輛火星車“祝融號”成功著陸。“祝融號”火星車的車身選用高強韌性的新型鋁基碳化硅復合材料。碳化硅(SiC)屬于( )
2.2021年5月,我國首輛火星車“祝融號”成功著陸。“祝融號”火星車的車身選用高強韌性的新型鋁基碳化硅復合材料。碳化硅(SiC)屬于( )A.單質 B.化合物 C.酸 D.堿 組卷:45引用:4難度:0.7 -
3.電解質是一類在水溶液里或熔融狀態下能夠導電的化合物.下列物質屬于電解質的是( )
A.Cu B.K2SO4 C.MgCl2溶液 D.NaOH溶液 組卷:141引用:10難度:0.9 -
4.當光束通過下列分散系時,能觀察到丁達爾效應的是( )
A.硫酸鈉溶液 B.硫酸溶液 C.氫氧化鉀溶液 D.氫氧化鐵膠體 組卷:5引用:1難度:0.5 -
5.下列電離方程式書寫錯誤的是( )
A.HNO3═H++NO3- B.KOH═K++OH- C.Fe2(SO4)3═Fe23++3SO42- D.NH4NO3═NH4++NO3- 組卷:34引用:3難度:0.6 -
6.下列說法中,正確的是( )
A.CO2的摩爾質量為44g B.1 mol N2的質量是14g C.標準狀況下,1 mol CO2所占的體積約是22.4L D.將40 g NaOH溶于1 L水中,所得溶液中NaOH的物質的量濃度為1 mol/L 組卷:746引用:3難度:0.9 -
7.下列行為不符合安全要求的是( )
A.點燃甲烷(CH4)前,必須檢驗氣體的純度 B.大量氯氣泄漏時,迅速離開現場并盡量往低處去 C.做實驗剩余的金屬鈉,沒有丟棄在廢液缸中而放回原試劑瓶中 D.稀釋濃硫酸時,將濃硫酸沿器壁緩慢注入水中并不斷攪拌 組卷:9引用:2難度:0.8 -
8.在強酸性溶液中能大量共存的無色透明離子組是( )
A.K+、Na+、 、NO-3MnO-4B.K+、Na+、Br-、CH3COO- C.Mg2+、Na+、Cl-、 SO2-4D.Na+、Ba2+、OH-、 SO2-4組卷:17引用:3難度:0.7 -
9.下列離子方程式正確的是( )
A.澄清的石灰水與鹽酸反應 Ca(OH)2+2H+=Ca2++2H2O B.鈉與水的反應 Na+2H2O=Na++2OH-+H2↑ C.銅片插入硝酸銀溶液 Cu+Ag+=Cu2++Ag D.大理石溶于醋酸CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ 組卷:9引用:3難度:0.7 -
10.下列離子方程式正確的是( )
A.石灰水與過量碳酸氫鈉溶液反應: +Ca2++OH-=CaCO3↓+H2OHCO-3B.氫氧化鋇溶液中加入硫酸氫鈉溶液至中性:H++ +Ba2++OH-=BaSO4↓+H2OSO2-4C.氧化銅與稀硫酸反應:2H++O2-=H2O D.碳酸鈉溶液與足量鹽酸反應: +2H+=CO2↑+H2OCO2-3組卷:17引用:1難度:0.7
第二部分非選擇題(共50分)
-
31.以廢鐵屑(含少量Fe2O3、FeS等雜質)為原料,制備硫酸亞鐵晶體(FeSO4?7H2O),流程示意圖如圖。
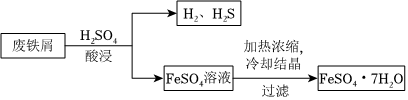
(1)H2SO4的電離方程式是。
(2)酸浸過程中,H2SO4的作用是FeS+2H+=Fe2++H2S↑、(用離子方程式表示)。
(3)測定所得硫酸亞鐵晶體中Fe2+的含量,步驟如下:
Ⅰ:稱取ag硫酸亞鐵晶體樣品,配制成100mL溶液。
Ⅱ:取出10mL溶液,加入適量稀硫酸,滴入bmol?L-1的KMnO4溶液,至反應完全共消耗KMnO4溶液cmL。
①Ⅰ中配制溶液用到的玻璃儀器有燒杯、玻璃棒、膠頭滴管和;
②Ⅱ中氧化Fe2+的離子方程式是MnO-4;
③計算硫酸亞鐵晶體樣品中Fe2+的質量分數。組卷:17引用:1難度:0.5 -
32.設計實驗探究NO的氧化性。
實驗Ⅰ:用排水法收集一瓶NO,將其倒扣在盛有堿性Na2SO3溶液的水槽中,振蕩,觀察到集氣瓶中液面上升。
資料:ⅰ.NO與堿性Na2SO3溶液會發生氧化還原反應,NO被還原為N2。O2-2
ⅱ.Ag+與N2反應生成黃色沉淀。O2-2
某同學認為,需通過進一步實驗驗證NO的氧化性,補充以下實驗:
實驗Ⅱ:取飽和Na2SO4溶液,加入少量冰醋酸,再滴加5滴0.1mol/L的AgNO3溶液,無明顯變化。
實驗Ⅲ:
(1)取少量實驗Ⅰ反應后集氣瓶中的溶液,加入少量冰醋酸,再滴加5滴0.1mol/L的AgNO3溶液,(填實驗現象)。
上述實驗證明NO有氧化性。
(2)實驗Ⅱ的目的是。
(3)寫出NO與堿性Na2SO3溶液反應的離子方程式。
(4)一個氧化還原反應可以看成“氧化”和“還原”兩個半反應,試用此角度分析NO與堿性Na2SO3溶液的反應。若還原反應為:2NO+2e-=N2,則氧化反應為:O2-2。
(5)某同學結合所學知識設計處理工業廢氣中SO2和NO的實驗方案,達到消除污染,保護環境的目的。
①先用飽和純堿溶液吸收廢氣中的SO2,生成NaHCO3,寫出該反應的離子方程式。
②再向生成的溶液中加入一定量,以此溶液來吸收NO氣體。組卷:7引用:1難度:0.5


