2022-2023學年北京市牛欄山一中高三(上)期中化學試卷
發布:2024/11/27 2:0:2
一、第Ⅰ卷(選擇題共42分)(共14小題,每小題3分。在每小題列出的四個選項中,選出符合題目答案的一項)
-
1.下列發電廠、電站的電能由化學能直接轉化而成的是( )
A.水力發電站 B.地熱發電廠 C.風力發電廠 D.燃料電池發電站 組卷:20引用:2難度:0.7 -
2.下列食品添加劑中,其使用目的與反應速率有關的是( )
A.抗氧化劑 B.調味劑 C.著色劑 D.增稠劑 組卷:1720引用:89難度:0.8 -
3.下列有關說法中,正確的是( )
A.糖類、油脂、蛋白質、核酸都能發生水解 B.向蛋白質溶液中加入AgNO3溶液,會產生白色沉淀,加水后又溶解 C.淀粉遇KI溶液變藍 D.DNA分子中的兩條多聚核苷酸鏈上的堿基通過氫鍵作用進行配對,最終形成雙螺旋結構 組卷:47引用:1難度:0.6 -
4.下列說法正確的是( )
A.需要加熱才能發生的反應一定是吸熱反應 B.原電池的電極材料中必須至少有一極是金屬 C.犧牲陽極法是利用了電解原理 D.用電解法實現鐵上鍍銅,銅作陽極,鐵作陰極 組卷:8引用:1難度:0.5 -
5.因發生氧化還原反應使溶液pH降低的是( )
A.向Mg(OH)2懸濁液中滴加FeCl3溶液,固體由白色變為紅褐色 B.向K2Cr2O7酸性溶液中加入乙醇,溶液由橙色變為綠色 C.向溴水中通入少量SO2氣體,溴水顏色變淺 D.用明礬[KAl(SO4)2?12H2O]處理污水 組卷:4引用:1難度:0.8 -
6.下列說法不正確的是( )
A.同溫同壓下,O2和CO2的密度不同 B.質量相同的H2O和D2O(重水)所含的電子數相同 C.物質的量相同的CH3CH2OH和CH3OCH3所含共價鍵數相同 D.室溫下,1LpH=1的鹽酸和硫酸,消耗1mol/LNaOH的體積相同 組卷:20引用:1難度:0.8
二、第Ⅱ卷(非選擇題共58分)
-
18.MnCO3是重要化工原料,由MnO2制備MnCO3一種工藝流程如下:
Ⅰ.研磨MnO2,加水配成濁液。
Ⅱ.MnO2濁液經還原、純化、制備等過程,最終獲得MnCO3固體。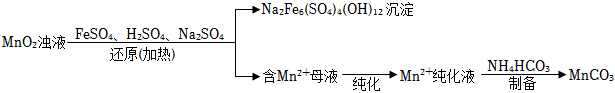
資料:
①MnCO3不溶于水。該工藝條件下,MnO2與H2SO4不反應。
②難溶電解質的溶度積:Ksp[Fe(OH)3]=2.8×10-39,Ksp[Mn(OH)2]=2.0×10-13
(1)研磨MnO2的目的是。
(2)MnO2氧化Fe2+為Fe3+的離子方程式為。
①根據上述反應,還原MnO2所需的H+與Fe2+的物質的量比值應為2。而實際上加入的酸要少一些,請結合含鐵產物解釋原因。
②取少量母液,滴加溶液,未產生藍色沉淀,說明溶液中不存在Fe2+。
(3)純化
向母液中滴加氨水調pH,除去殘留的Fe3+。若母液中c(Mn2+)=1mol?L-1,使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5mol?L-1,溶液中c(OH-)至少為mol?L-1,則溶液中,所以此時不會有Mn(OH)2,沉淀生成。(已知≈6.5)。3280
(4)制備
將Mn2+純化液與稍過量的NH4HCO3,溶液混合,得到含MnCO3的濁液。將濁液過濾,洗滌沉淀,干燥后得到MnCO3固體。
①通過檢驗SO42-來判斷沉淀是否洗滌干凈。檢驗SO42-的操作是取最后一次洗滌液,,說明沉淀已洗滌干凈。
②生成MnCO3的離子方程式是。組卷:12引用:1難度:0.5 -
19.陽極泥處理后的沉渣中含AgCl,工業上可用Na2SO3溶液作浸取劑浸出回收。某小組在實驗室模擬該過程。
已知:
i.25oC時,部分物質的溶解度:
AgCl 1.9×10-4 g;Ag2SO3 4.6×10-4 g;Ag2SO40.84 g。
ii.25oC時,亞硫酸鈉溶液酸化過程中含微粒的物質的量分數隨pH變化如圖所示。+4S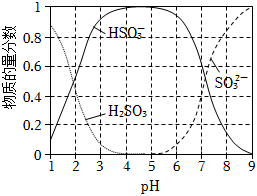
Ⅰ.浸出氯化銀
取AgCl固體,加入1 mol/L Na2SO3溶液作浸取劑,充分反應后過濾得到浸出液(pH=8),該過程中發生的反應為AgCl+2?[Ag(SO3)2]3-+Cl-。SO2-3
(1)用平衡移動原理解釋AgCl溶解的原因是。
Ⅱ.酸化沉銀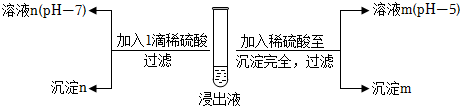
(2)經檢測,沉淀m為AgCl,則溶液m中含微粒的主要存在形式是+4S。
(3)探究沉淀n的成分。
①甲同學認為沉淀n一定不含Ag2SO4,其依據是。
②乙同學認為沉淀n可能含Ag2SO3,進行實驗驗證。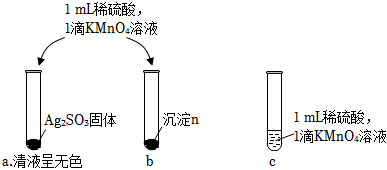
i.本實驗設計的依據是:Ag2SO3具有性。
ii.乙同學觀察到,得出結論“沉淀n不含Ag2SO3”。
③丙同學從溶液n的成分角度再次設計實驗證明沉淀n不含Ag2SO3。
i.本實驗設計的依據是:若沉淀n含Ag2SO3,則溶液n中含微粒的總物質的量+1Ag(填“>”、“=”或“<”)Cl-物質的量。
ii.結合實驗現象簡述丙同學的推理過程:。
Ⅲ.浸取劑再生
(4)溶液m經處理后可再用于浸出AgCl,請簡述該處理方法。組卷:50引用:4難度:0.4


