2023-2024學年云南師大附中高一(上)開學化學試卷
發布:2024/9/5 4:0:8
一、選擇題;本題20小題,每小題2分,共40分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.下列不屬于天然有機高分子材料的是( )
A.棉花 B.塑料 C.羊毛 D.橡膠 組卷:46引用:3難度:0.9 -
2.有機反應CH3CH2OH+CH3COOH═CH3COOCH2CH3+H2O類似于無機反應中的( )
A.置換反應 B.分解反應 C.復分解反應 D.化合反應 組卷:21引用:2難度:0.7 -
3.過氧化氫(H2O2)是常見的過氧化物,下列物質也屬于過氧化物的是( )
A.MnO2 B.SiO2 C.CaO2 D.Fe3O4 組卷:38引用:2難度:0.5 -
4.下列說法不正確的是( )
A.標準狀況下(0℃,101kPa),x個氧氣分子的體積是aL,1個氧氣分子體積為 LaxB.酒香不怕巷子深,說明分子不斷地運動 C.水通電后生成氫氣和氧氣,說明在化學變化中分子可以再分 D.25m3的石油氣可以裝入0.024m3的鋼瓶中,說明分子之間有間隔 組卷:9引用:2難度:0.8 -
5.下列說法正確的是( )
①化合物主要包括:酸、堿、鹽和氧化物;
②按照分散質粒子直徑大小可將分散系分為溶液、濁液和膠體;
③溶液呈電中性,膠體帶有電荷;
④制備Fe(OH)3膠體,可向沸水中滴加FeCl3飽和溶液并長時間煮沸;
⑤氫氧化鐵、有色玻璃和果凍都是膠體;
⑥向飽和Ca(OH)2溶液中加入少量無水CaO固體,恢復原溫度,溶液中Ca(OH)2的質量分數不變;
⑦醋酸、燒堿和過氧化鈉分別屬于酸、堿和堿性氧化物;
⑧酸性氯化物不一定是非金屬氧化物,堿性氧化物一定是金屬氧化物A.②⑥⑧ B.①②④⑥ C.①②④⑦ D.②⑤⑧ 組卷:21引用:2難度:0.7 -
6.某K2CO3樣品中含有Na2CO3、KNO3和Ba(NO3)2三種雜質中的一種或兩種,現將6.9g樣品溶于足量水中,得到澄清溶液,若再加入過量的CaCl2溶液,得到4.5g沉淀,對樣品所含雜質的正確判斷是( )
A.肯定有KNO3和Na2CO3,沒有Ba(NO3)2 B.肯定有KNO3,沒有Ba(NO3)2,可能還有Na2CO3 C.肯定沒有Na2CO3和Ba(NO3)2,可能有KNO3 D.以上判斷都不正確 組卷:67引用:25難度:0.5 -
7.下列有關離子共存的說法或離子方程式的書寫中,正確的一組是( )
A.加入NaOH溶液后的溶液中能大量共存的離子: 、Al3+、Cl-、NH+4SO2-4B.pH═1的溶液中能大量共存的離子:Fe3+、Mg2+、Cl-、 SO2-4C.能使酚酞溶液變紅的溶液中能大量共存的離子:K+、 、Na+、HS-CO2-3D.加NH4HCO3溶液并加熱有氣體產生的溶液:Fe3+、Na+、Cl-、CH3COO- 組卷:176引用:2難度:0.7 -
8.向四支試管中分別加入少量不同的無色溶液進行如下操作,其中結論正確的是( )
選項 操作 現象 結論 A 滴加BaCl2溶液 生成白色沉淀 原溶液中有SO42- B 滴加氯水和CCl4,振蕩、靜置 下層溶液顯紫紅色 原溶液中有I- C 用潔凈的鉑絲蘸取溶液進行焰色試驗 火焰呈黃色 原溶液中有Na+、無K+ D 滴加適量稀鹽酸,再滴加AgNO3溶液 產生白色沉淀 原溶液中有Cl- A.A B.B C.C D.D 組卷:14引用:6難度:0.7
二、綜合題:60分
-
24.Ⅰ.甲、乙、丙是三種不含相同離子的可溶性強堿或鹽,其相對分子質量:甲<乙<丙,它們所含離子如下表所示:
(1)丙是陽離子 、Mg2+、Ba2+NH+4陰離子 OH-、 、Cl-NO-3。
(2)甲有兩種可能,為了確定是哪種可能,請設計實驗確定甲的物質組成,操作為:。
Ⅱ.某化學興趣小組在探究“復分解反應發生的條件”時,選做了如圖所示的三個實驗(提示:BaCl2溶液呈中性。)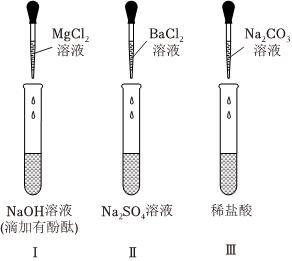
甲同學:向試管Ⅰ中慢慢滴入MgCl2溶液,并不斷振蕩,至溶液顏色恰好變為無色為止。
乙同學:分別完成試管Ⅱ和Ⅲ中的兩個實驗后,接著進行如下探究。請分析后作答: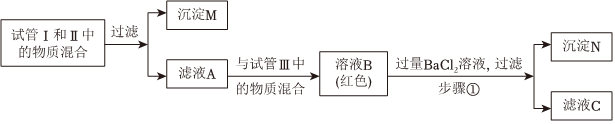
(3)甲同學經過分析推斷,試管Ⅲ反應后所得溶液中一定含有的溶質是(填化學式);步驟①中一定發生的反應的化學方程式是。
(4)乙同學把沉淀M、N混合后加入AgNO3溶液和過量的稀硝酸,觀察到的實驗現象是;實驗結束,乙同學把反應后的混合物與濾液C全部倒入廢液缸中,則廢液缸內上層清液中,除酚酞和H+、外一定含有的離子有NO-3(填離子符號)。組卷:49引用:3難度:0.7 -
25.有化學家說“如果沒有溶液,化學將無法在科學世界里擁有一級學科地位。”
(1)中學階段常常將溶解過程簡單看作物理變化過程,但溶解過程中可能包含化學變化早已得到了證實。下列事實能說明溶解過程中存在化學變化的是(填字母)。
A.無水硫酸銅白色,硫酸銅溶液藍色
B.氨氣溶于水后滴加酚酞,溶液變成紅色
C.液態氯化氫不導電,鹽酸的導電性比水強
(2)絕大多數化學反應選擇在溶液中進行的,這是因為在溶液中反應有利于。
(3)有一包粉末,已知由CaCO3、CuSO4、MgCl2、Na2SO4、NaOH、NaNO3中的2種或2種以上物質組成。為了確定其成分,進行以下實驗(假設各步反應已充分):取一定質量的粉末,加水攪拌后過濾,得到沉淀甲和無色溶液A;向沉淀甲中加入足量稀鹽酸,得到無色氣體和藍色溶液:對無色溶液A進行實驗,實驗步驟和現象如圖所示: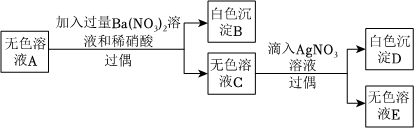
①由此可以得出的結論是:白色粉末中一定存在的化合物是,可能存在的化合物是。
②寫出得到沉淀甲發生的反應方程式。
③生成白色沉淀B的反應方程式。
(4)除了水是常見的溶劑外,乙醇等也可以作溶劑。下表是一些物質25℃時在無水乙醇中的溶解度(100g溶劑)。
請選用表中兩種物質作反應物,寫出它們在無水乙醇中發生復分解反應的化學方程式物質 Ca(NO3)2 CaCl2 Ba(NO3)2 BaBr2 CaBr2 NaOH NaCl 溶解度/g 339 20.5 0.002 3.96 34.8 14.7 0.07 。組卷:13引用:1難度:0.7


