2021-2022學年內蒙古赤峰二中高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題:本題共16小題,每小題3分,共48分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.下列有關化學用語表示正確的是( )
A.氯乙烯的結構簡式:CH2CHCl B.丙烷分子的球棍模型示意圖: 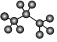
C.丙烯的鍵線式: 
D.醛基的電子式: 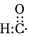 組卷:13引用:1難度:0.6
組卷:13引用:1難度:0.6 -
2.2021年8月25日是全國低碳日,主題為“低碳生活,綠建未來”。下列措施有利于節能減排、保護環境的是( )
①加快化石燃料的開采與使用
②研發易降解的生物農藥
③應用高效潔凈的能源轉化技術
④田間焚燒秸稈
⑤推廣使用節能環保材料A.①③⑤ B.①②④ C.②③⑤ D.②④⑤ 組卷:10引用:2難度:0.7 -
3.下列各組有機物中,互為同分異構體的是( )
A. 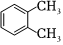 和
和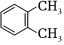
B. 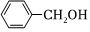 和
和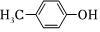
C. 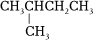 和
和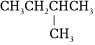
D. 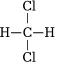 和
和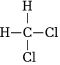 組卷:180引用:3難度:0.6
組卷:180引用:3難度:0.6 -
4.某烷烴的結構簡式為
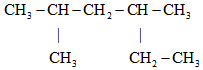 ,其系統命名是( )
,其系統命名是( )A.2,4-二甲基己烷 B.4-甲基-2-乙基戊烷 C.2-甲基-4-乙基戊烷 D.3,5-二甲基己烷 組卷:237引用:13難度:0.7 -
5.以下用于研究有機物的方法錯誤的是( )
A.蒸餾常用于分離提純液態有機混合物 B.燃燒法是研究確定有機物成分的有效方法 C.核磁共振氫譜通常用于分析有機物的相對分子質量 D.對有機物分子紅外光譜圖的研究有助于確定有機物分子中的官能團 組卷:483引用:15難度:0.9 -
6.某一反應物的濃度是2.0mol?L-1,經過4min后,它的濃度變成1.68mol?L-1,則在這4min內它的平均反應速率為( )
A.0.04mol?L-1?min-1 B.0.08mol?L-1?min-1 C.0.1mol?L-1?min-1 D.0.2mol?L-1?min-1 組卷:57引用:3難度:0.8
二、非選擇題:本題共4小題,共52分。
-
19.丙烯(C3H6)是石油化工行業重要的有機原料之一,主要用于生產聚丙烯、二氯丙烷、異丙醇等產品。回答下列問題:
(1)丙烷脫氫制備丙烯。由圖可得C3H8(g)?C3H6(g)+H2(g)ΔH=。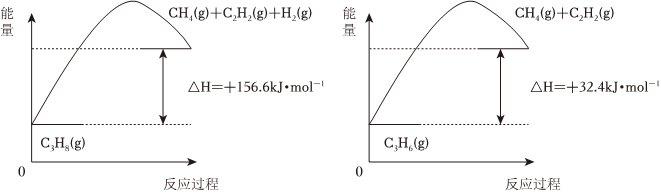
①為了同時提高反應速率和反應物的平衡轉化率,可采取的措施是。
②目前在丙烷脫氫制丙烯時常通入適量的O2,讓其同時發生下列反應2C3H8(g)+O2(g)?2C3H6(g)+2H2O(g)ΔH=-235kJ?mol-1,通入O2的目的是。
(2)以C4H8和C2H4為原料發生烯烴歧化反應:C4H8(g)+C2H4(g)?2C3H6(g)ΔH>0。
①某溫度下,上述反應中,正反應速率為v正=K正c(C4H8)?c(C2H4)、逆反應速率為v逆=K逆c2(C3H6),其中K正、K逆為速率常數,該反應使用WO3/SiO2為催化劑,該反應化學平衡常數K=(用K正、K逆表示),下列說法中正確的是(填標號)。
A.催化劑參與了歧化反應,但不改變反應歷程
B.催化劑使K正和K逆增大相同的倍數
C.催化劑降低了烯烴歧化反應的活化能,增大了活化分子百分數
D.速率常數的大小與反應程度無關系
②已知t1min時達到平衡狀態,測得此時容器中n(C4H8)=amol,n(C2H4)=2amol,n(C3H6)=bmol,且平衡時C3H6的體積分數為25%。再往容器內通入等物質的量的C4H8和C2H4,在新平衡中C3H6的體積分數(填“>”“<”或“=”)25%.
(3)工業上可用丙烯加成法制備1,2-二氯丙烷(CH3ClCHClCH3),主要副產物為3-氯丙烯(CH2=CHCH2Cl),反應原理為:
Ⅰ.CH2=CHCH3(g)+Cl2(g)?CH2ClCHClCH3(g)
Ⅱ.CH2=CHCH3(g)+Cl2(g)?CH2=CHCH2Cl(g)+HCl(g)
一定溫度下,向恒容密閉容器中充入等物質的量的CH2=CHCH3(g)和Cl2(g)。在催化劑作用下發生反應Ⅰ,容器內氣體的壓強隨時間的變化如表所示。
①用單位時間內氣體分壓的變化來表示反應速率,即v=時間/min 0 60 120 180 240 300 360 壓強/kPa 80 74.2 69.2 65.2 61.6 57.6 57.6 ,則前120min內平均反應速率v(CH2ClCHClCH3)=ΔpΔtkPamin-1。
②該溫度下,若平衡時的體積分數為12.5%,反應Ⅰ的平衡常數Kp=kPa-1(Kp為以分壓表示的平衡常數,保留小數點后2位)。組卷:9引用:1難度:0.6 -
20.(1)第三代混合動力車,目前一般使用鎳氫電池,該電池中鎳的化合物為正極,儲氫金屬(以M表示)為負極,堿液(主要KOH)為電解質溶液。鎳氫電池充放電原理如圖1所示,其總反應式為H2+2NiOOH
2Ni(OH)2。根據所給信息判斷,混合動力車上坡或加速時,乙電極周圍溶液的pH充電放電(填“增大”“減小”或“不變”)。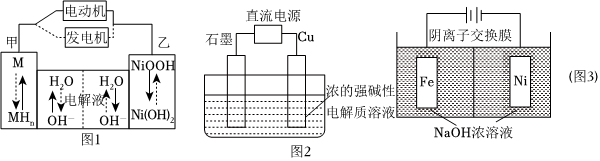
(2)Cu2O是一種半導體材料,可通過如圖2所示的電解裝置制取,電解總反應式為2Cu+H2OCu2O+H2↑,陽極的電極反應式是通電。用鎳氫電池作為電源進行電解,當電池中有1molH2被消耗時,Cu2O的理論產量為g。
(3)高鐵酸鈉(Na2FeO4)易溶于水,是一種新型多功能水處理劑,可以用電解法制取:Fe+2H2O+2OH-通電+3H2↑,工作原理如上圖3所示。裝置通電后,鐵電極附近生成紫紅色的FeO2-4,鎳電極有氣泡產生。電解一段時間后,c(OH-)降低的區域在FeO2-4(填“陰極室”或“陽極室”);陽極反應式為:。組卷:16引用:3難度:0.6


