人教版(2019)選擇性必修1《3.4.2 沉淀溶解平衡的應用》2023年同步練習卷(5)
發布:2024/8/16 13:0:1
一、選擇題
-
1.實驗:
①0.1mol?L-1AgNO3溶液和0.1mol?L-1NaCl溶液等體積混合得到濁液a,過濾得到濾液b和白色沉淀c;
②向濾液b中滴加0.1mol?L-1KI溶液,出現渾濁;
③向沉淀c中滴加0.1mol?L-1KI溶液,沉淀變為黃色.
下列分析不正確的是( )A.濁液a中存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq) B.濾液b中不含有Ag+ C.③中顏色變化說明AgCl轉化為AgI D.實驗可以證明AgI比AgCl更難溶 組卷:1375引用:52難度:0.9 -
2.如表所示是三種物質的溶解度(20℃),下列說法正確的是( )
物質 MgCl2 Mg(OH)2 MgCO3 溶解度(g/100g H2O) 54.8 9×10-4 0.01 A.含有MgCO3固體的溶液中,都有c(Mg2+)=c(CO32-) B.將表中三種物質分別與水混合,加熱、灼燒,最終的固體產物相同 C.除去粗鹽中含有的Mg2+雜質,最佳除雜試劑為Na2CO3溶液 D.用石灰水處理含有Mg2+和HCO3-的硬水,發生反應的離子方程式為Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+MgCO3↓+2H2O 組卷:9引用:6難度:0.5
三、解答題
-
10.請按要求回答下列問題:
Ⅰ.已知H2A在水中的電離如下:H2A═H++HA-,HA-?H++A2-。
(1)常溫下NaHA溶液的pH(填字母,下同),原因是。
A.大于7
B.小于7
C.等于7
D.無法確定
(2)某溫度下,若向0.1mol?L-1的NaHA溶液中逐滴滴加0.1mol?L-1KOH溶液至溶液呈中性(忽略混合后溶液的體積變化)。此時該混合溶液中的下列關系一定正確的是。
A.c(H+)?c(OH-)=1.0×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05mol?L-1
(3)已知常溫下H2A的鈣鹽(CaA)的飽和溶液中存在以下平衡:CaA(s)?Ca2+(aq)+A2-(aq)ΔH>0。若要使該溶液中Ca2+濃度變小,可采取的措施有。
A.升高溫度
B.降低溫度
C.加入NH4Cl晶體
D.加入Na2A固體
Ⅱ.(4)已知25℃時,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。在25℃下,向濃度均為0.1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成沉淀(填化學式),生成該沉淀的離子方程式為。向0.0180mol?L-1的MgCl2溶液中,逐滴加入濃NaOH溶液,剛好出現沉淀時,溶液的pH為。(忽略溶液體積變化)
(5)25℃時,pH=5的CH3COOH溶液中,c(CH3COO-)=。(寫出計算式)組卷:30引用:2難度:0.5 -
11.水中溶氧量(DO)是衡量水體自凈能力的一個指標,通常用每升水中溶解氧分子的質量表示,單位mg?L-1.我國《地表水環境質量標準》規定,生活飲用水源的DO不能低于5mg?L-1.水中溶解氧的測定步驟如下:
(1)向一定量水樣中加入適量MnSO4和堿性KI 溶液,生成MnO(OH)2沉淀,密封靜置;
(2)加入適量稀H2SO4,攪拌,等MnO(OH)2與I-完全反應生成Mn2+和I2后;
(3)用Na2S2O3標準溶液滴定至終點.測定過程中物質的轉化關系如下:
O2MnO(OH)2Mn2+I2I-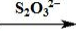 S4O2-6
S4O2-6
已知:MnO(OH)2+2I-+4H+═Mn2++I2+3H2O
2S2O32-+I2═S4O6 2-+2I-
①加入稀硫酸后攪拌的作用是;Na2S2O3標準溶液應裝在滴定管中(填酸式或堿式).
②滴定過程中以為指示劑;達到滴定終點的標志為.
③寫出O2將Mn2+氧化成MnO(OH)2的離子方程式;
④若加入的稀H2SO4溶液反應后,若溶液pH過低,滴定時會產生明顯的誤差.寫出產生誤差的一個原因(用離子方程式表示).
⑤下列操作使測得水樣中溶氧量(DO)比實際值偏高的是
A.第(1)步操作靜置時沒有密封 B.裝Na2S2O3標準溶液的滴定管沒有潤洗
C.滴定前錐形瓶洗凈后沒有干燥 D.滴定前讀數正確,滴定后俯視讀數
⑥取加過一定量CaO2?8H2O的池塘水樣100.00mL,按上述方法測定水中溶解氧量,消耗0.01000mol?L-1 Na2S2O3標準溶液13.50mL.計算該水樣中的溶解氧為mg?L-1.組卷:20引用:3難度:0.3


