2023-2024學年遼寧省丹東市鳳城一中高二(上)月考化學試卷(10月份)
發布:2024/10/11 0:0:2
一、單項選擇題(每題只有一個選項符合題目要求,共15小題,每題3分,共45分。)
-
1.有關工業合成氨的說法錯誤的是( )
A.不斷移去液氨,有利于反應正向進行 B.400~500℃時,原料的平衡轉化率最大 C.增大壓強,氨的分解速率增加 D.原料氣須經過凈化處理,以防止催化劑中毒 組卷:99引用:2難度:0.8 -
2.氮及其化合物在生產生活中具有廣泛應用。氮氣經過一系列的變化可以合成氨、氮的氧化物、硝酸等重要的化工原料;NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,減少環境污染。對于反應4NH3(g)+5O2(g)?4NO(g)+6H2O(g)ΔH<0,下列有關說法不正確的是( )
A.升高溫度,該反應的平衡常數增大 B.催化劑降低了正、逆反應的活化能 C.1molN-H斷裂同時有1molO-H斷裂,說明達該條件下的平衡狀態 D.其它條件不變,加入高效的催化劑能提高單位體積內的活化分子百分數 組卷:22引用:3難度:0.7 -
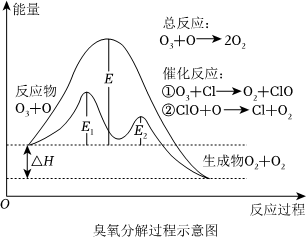 3.臭氧分解過程如圖所示,下列說法正確的是( )
3.臭氧分解過程如圖所示,下列說法正確的是( )A.催化反應①②均為放熱反應 B.決定O3分解反應速率的是催化反應② C.E1是催化反應①對應的正反應的活化能,(E2+ΔH)是催化反應②對應的逆反應的活化能 D.溫度升高,總反應的正反應速率增加,逆反應速率減小 組卷:32引用:4難度:0.7 -
4.常溫條件下,下列有關電解質溶液的說法正確的是( )
A.加水稀釋鹽酸時,溶液中所有離子劑濃度均減小 B.將10mL0.01mol/LNaOH溶液與同濃度的HA溶液混合,若混合后溶液呈中性,則消耗的HA的體積V≤10mL C.等濃度的①NH4Cl溶液②NH4HSO4溶液③NH4HCO3溶液中,②中的c( )最小NH+4D.室溫下,向0.1mol/L氨水中加少量NH4Cl固體,溶液中 減小c(OH-)c(NH3?H2O)組卷:19引用:1難度:0.6 -
5.下列各組離子能大量共存,且加入相應試劑后發生反應的離子方程式正確的是( )
選項 離子組 加入試劑 加入試劑后發生的離子反應 A I-、 、NH+4SO2-4H2O2溶液 2I-+2H2O2=I2+2H2O+O2↑ B K+、 、AlO-2NO-3AlCl3溶液 Al3++3 +6H2O═4Al(OH)3AlO-2C Ag+、Ba2+、S2- H2SO4溶液 2H++S2-=H2S↑ D Fe3+、Cl-、SCN- NaOH溶液 Fe3++3OH-=Fe(OH)3↓ A.A B.B C.C D.D 組卷:11引用:1難度:0.7 -
6.將濃度為0.1mol?L-1HF溶液加水不斷稀釋,下列各量始終保持減小的是( )
A.n(H+) B.c(OH-) C. c(F-)c(H+)D. c(H+)c(HF)組卷:10引用:3難度:0.8
第II卷(非選擇題)
-
18.含氮化合物和含碳化合物對環境、生產和人類生命活動有很大影響。請回答下列有關問題:
Ⅰ、用CH4將氮氧化合物還原為無毒氣體,可改善汽車尾氣對環境的影響相關反應歷程如圖所示。
(1)反應a加入催化劑,可使Ea1(填“增大”“減小”或“不變”),相同條件下,反應速率b比a(填“快”或“慢”),原因是。
(2)T℃時,向恒容密閉容器中加入一定量的CH4和NO2,下列能表明反應CH4(g)+2NO2(g)?N2(g)+2H2O(g)+CO2(g)已達到平衡狀態的是(填字母)。
A.容器內氣體顏色保持不變
B.v正(N2)=2v逆(NO2)
C.容器內壓強保持不變
D.容器內混合氣體的密度保持不變
Ⅱ、反應CO(g)+2H2(g)?CH3OH(g)ΔH<0是一種碳資源化處理的途徑,在不同溫度下,向容積為2L的密閉容器內加入4mol的CO和8molH2,CH3OH的物質的量隨時間的變化情況如圖:
(1)T1T2(填“>”或“<”)。
(2)已知:v正=k正x(CO)?x2(H2),v逆=k逆x(CH3OH),k正和k逆分別為正、逆反應速率常數,x為物質的量分數,c點時v正:v逆=。組卷:12引用:1難度:0.5 -
19.Ⅰ.25℃時,制備亞硝酰氯所涉及的熱化學方程式和平衡常數如下表。
(1)則該溫度下,ΔH3=熱化學方程式 平衡常數 ① 2NO2(g)+NaCl(s)?NaNO3(s)+NOCl(g) ΔH1=akJ?mol-1 K1 ② 4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g) ΔH2=bkJ?mol-1 K2 ③ 2NO(g)+Cl2(g)?2NOCl(g)ΔH3 K3 kJ?mol-1;K3=(用K1和K2表示)。
Ⅱ.(1)25℃時,在體積為2L的恒容密閉容器中通入0.08molNO和0.04molCl2發生上述反應③,若反應開始與結束時溫度相同,數字壓強儀顯示反應過程中壓強(p)隨時間(t)的變化如圖Ⅰ實線所示,則ΔH3(填“>”“<”或“=”)0;
(2)若其他條件相同,僅改變某一條件,測得其壓強隨時間的變化如圖Ⅰ虛線所示,則改變的條件是;
(3)5min時,再充入0.08molNO和0.04molCl2,則達平衡后NO的體積分數將(填“增大”“減小”或“不變”)。
(4)圖Ⅱ是甲、乙兩同學描繪上述反應③的平衡常數的對數值(lgK)與溫度的變化關系圖,其中正確的曲線是(填“甲”或“乙”)。
Ⅲ.在300℃下,將CO2和H2按物質的量之比為1:3通入一恒容密閉容器中,容器壓強為8MPa,發生反應CO2(g)+3H2(g)?CH3OH(g)+H2O(g),達到平衡時,測得CO2的平衡轉化率為50%,則該反應條件下的平衡常數為Kp=(用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)。組卷:19引用:1難度:0.5


