2020-2021學年陜西省咸陽市高一(下)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本大題共16小題,每小題3分,計48分。每小題只有一個選項是符合題意的)
-
1.“一帶一路”是跨越時空的宏偉構思,賦予古絲綢之路嶄新的時代內涵。下列古絲綢之路的商品的主要成分不屬于有機物的是( )
A.絲綢 B.茶葉 C.陶瓷 D.香料 組卷:25引用:1難度:0.8 -
2.下列資源的開發利用中,不涉及化學變化的是( )
A.用乙烯制聚乙烯 B.用蒸餾法淡化海水 C.海帶提碘 D.煤的干餾 組卷:10引用:2難度:0.8 -
3.下列有機物不能發生水解反應的是( )
A.蛋白質 B.淀粉 C.油脂 D.乙烷 組卷:17引用:1難度:0.8 -
4.“中國芯”的主要原材料是高純度單晶硅,反應SiCl4(g)+2H2(g)
Si(s)+4HCl(g)可用于純硅的制備。SiCl4中存在的鍵型是( )高溫A.極性共價鍵 B.非極性共價鍵 C.離子鍵 D.共價鍵和離子鍵 組卷:34引用:1難度:0.8 -
5.下列說法不正確的是( )
A.鉛蓄電池屬于二次電池 B.CH3CH2OH和CH3COOH具有相同的官能團 C. C與126C互為同位素136D.正丁烷與異丁烷互為同分異構體 組卷:17引用:1難度:0.8 -
6.以下對我國古代文獻中有關記載的化學解釋不正確的是( )
A.《本草綱目》中“凡酸壞之酒,皆可蒸燒”描述的是乙醇的燃燒 B.《華陽國志》中“取井火煮之,一斛水得五斗鹽”,產生“井火”的氣體主要成分為CH4 C.《格物粗談》中“紅柿摘下未熟,每籃用木瓜三枚放入,得氣即發,并無澀味”,文中的“氣”是指乙烯 D.《肘后備急方》中“青蒿一握,以水二升漬,絞取汁,盡服之。”涉及的操作是萃取 組卷:20引用:2難度:0.8 -
7.能一次區分乙醇、乙酸、葡萄糖溶液三種物質的試劑是(可加熱)( )
A.水 B.酸性KMnO4溶液 C.紫色石蕊試液 D.新制氫氧化銅 組卷:10引用:1難度:0.7
二、非選擇題(本大題共5小題,計52分)
-
20.研究化學反應中的能量變化,有助于人們更好地利用化學反應為生產和生活服務。
(1)用Cl2生產某些含氯有機物時會產生副產物HCl,利用下列反應可實現氯的循環利用:
4HCl+O22Cl2+2H2OCuO/CuCl2400℃
已知:
a.上述反應中,4mol HCl被氧化,放出115.6 kJ的熱量;
b.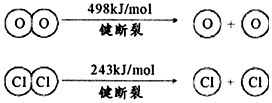
①H2O的電子式為。
②斷開1mol H-O鍵與斷開1mol H-Cl鍵所需能量相差約為kJ,H2O中H-O鍵比HCl中H-Cl鍵(填“強”或“弱”)。
(2)我國“神舟”系列飛船的電源系統共有3種,分別是太陽能電池帆板、鎘鎳蓄電池和應急電池。飛船在光照區運行時,太陽能電池帆板將能轉化為能,除供給飛船使用外,多余部分用鎘鎳蓄電池儲存起來。
(3)科學家已研制出利用太陽能產生激光,并在二氧化鈦(TiO2)表面作用使海水分解得到氫氣的新技術:2H2O2H2↑+O2↑。制得的氫氣可用于燃料電池。激光TiO2
①太陽光分解海水過程中的能量變化如圖所示,則該反應屬于(填“放熱”或“吸熱”)反應。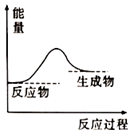
②某種氫氧燃料電池可用20% KOH溶液作電解質,正極反應式為O2+4e-+2H2O═4OH-,則電池的負極反應式為。供電過程中,當消耗氫氣11.2L(標準狀況下)時,假設電池的能量轉化效率為80%,則導線中轉移電子的物質的量為mol。組卷:9引用:1難度:0.6 -
21.乙酸乙酯是一種重要的化工原料,廣泛用于藥物染料等工業。某興趣小組同學欲制備并分離提純乙酸乙酯,實驗裝置如圖1所示:

已知:a.乙醇能與氯化鈣形成微溶于水的CaCl2?6C2H5OH;
b.2CH3CH2OHCH3CH2OCH2CH3(乙醚)+H2O;濃硫酸140℃
c.查閱資料得到下列數據:
(1)為防止加熱時液體暴沸,需要在試管a中加入碎瓷片。如果加熱一段時間后發現忘記加碎瓷片,應采取的操作是物質 乙醇 乙酸 乙酸乙酯 乙醚 沸點/℃ 78.0 118.0 77.5 34.6 密度/(g?cm-3) 0.8 1.1 0.9 0.7 水溶性 互溶 可溶 微溶 微溶 (填字母)。
A.立即補加
B.冷卻后補加
C.不需補加
D.重新配料
(2)生成乙酸乙酯的化學反應方程式為。
(3)試管b中飽和Na2CO3溶液的作用是。
(4)產品純化。從試管b中分離出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,首先向乙酸乙酯中加入無水氯化鈣,除去(填名稱);然后再加入無水硫酸鈉除去水,最后進行(填操作名稱),得到較純凈的乙酸乙酯。
(5)實驗中用30 g乙酸與46 g乙醇反應,若實際得到乙酸乙酯的質量是30.8 g,則該實驗中乙酸乙酯的產率為。
(6)為了證明濃硫酸在該反應中起催化劑和吸水劑的作用,小組同學利用圖1裝置進行了以下4個實驗。實驗開始先用酒精燈微熱3min,再加熱使之微微沸騰3 min。實驗結束后充分振蕩試管b再測有機層的厚度,實驗記錄如下:
①實驗D的目的是與實驗C相對照,證明H+對酯化反應具有催化作用。實驗D中應加入鹽酸的體積和濃度分別是實驗編號 試管a中試劑 試管b中試劑 有機層的厚度/cm A 2mL乙醇、1mL乙酸、3mL18mol?L-1濃硫酸 飽和Na2CO3 3.0 B 2mL乙醇、1mL乙酸 0.1 C 2mL乙醇、1mL乙酸、3mL2mol?L-1 H2SO4 0.6 D 2mL乙醇、1mL乙酸、鹽酸 0.6 mL和mol?L-1。
②分析實驗(填實驗編號)的數據,可以推測出濃H2SO4的吸水性提高了乙酸乙酯的產率。
(7)另一化學小組同學設計如圖2所示的裝置制取乙酸乙酯(鐵架臺、鐵夾、加熱裝置均已略去)。此裝置和圖1裝置相比,優點是(寫一個)。組卷:28引用:1難度:0.7


