2022年湖北省襄陽五中高考化學適應性試卷(五)
發布:2024/4/20 14:35:0
一、選擇題:(本題共15小題,每小題3分,共45分,只有一項是符合題目要求的。)
-
1.北京冬奧會期間,“冰絲帶”場館安裝發電玻璃實現零碳供電,原理是在玻璃表面涂抹一層碲化鎘,使其具有光電轉換功能。下列說法正確的是( )
A.碲元素在元素周期表中位于d區 B. Te原子核內中子數為12812852C.112Cd與114Cd互為同位素 D.發電玻璃的發電過程是化學能轉化為電能 組卷:9引用:1難度:0.7 -
2.化學與科技、社會、生產密切相關,下列有關說法正確的是( )
A.乙醇汽油的廣泛使用不能減少汽車尾氣中NOx的排放 B.“神舟十三號”逃逸系統復合材料中的酚醛樹脂屬于天然高分子材料 C.艦艇隱形涂料中可以使用摻雜態聚乙炔作為絕緣材料,聚乙炔可通過加聚反應制得 D.響應“綠色辦奧”理念,燃煤中摻入一些生石灰以實現“碳中和” 組卷:14引用:2難度:0.8 -
3.NA為阿伏加德羅常數的值。下列說法錯誤的是( )
A.0.1molH2和0.1molI2于密閉容器中充分反應后,其分子總數為0.2NA B.23gCH3CH2OH中sp3-sσ鍵數目為3NA C.0.1mol/L醋酸鈉水溶液中CH3COO-與OH-離子數之和略大于0.1NA D.標準狀況下,11.2L乙烯和環丙烷的混合氣體中所含原子數小于4.5NA 組卷:6引用:2難度:0.7 -
4.下列相關條件下的離子方程式書寫正確的是( )
A.泡沫滅火器原理:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑ B.侯德榜制堿法的反應之一:Na++CO2+NH3+H2O=NaHCO3↓+NH4+ C.碳酸氫鎂溶液中滴加過量的燒堿溶液:Mg2++2HCO3-+2OH=2H2O+MgCO3↓+CO32- D.海水提溴工藝中,用純堿溶液富集Br2:Br2+2OH-=Br-+BrO-+H2O 組卷:14引用:3難度:0.7 -
5.復興號高鐵車體材質用到Mn、Co等元素。Mn的一種配合物化學式為[Mn(CO)5(CH3CN)],下列說法錯誤的是( )
A.Mn原子的配位數為6 B.CH3CN與Mn原子配位時,提供孤電子對的是N原子 C.CH3CN中C原子的雜化類型為sp2、sp3 D.CH3CN中σ鍵和π鍵數目之比為5:2 組卷:14引用:2難度:0.7 -
6.CalebinA 可用于治療阿爾茨海默病,在其合成過程中有如圖物質轉化過程:
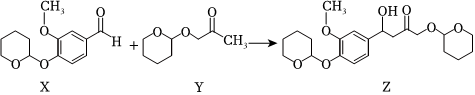
下列有關化合物X、Y和Z的說法正確的是( )A.X有3種含氧官能團 B.X、Y和Z均可發生水解反應 C.可用新制Cu(OH)2懸濁液檢驗Z中是否混有X D.將Z與NaOH乙醇溶液共熱,可發生消去反應 組卷:49引用:5難度:0.7
二、非選擇題:(共55分)
-
18.次磷酸鈉(NaH2PO2)是一種白色粉末,微溶于無水乙醇,不溶于乙醚,具有強還原性,酸性條件下易被氧化生成H3PO4。實驗室使用白磷、熟石灰和碳酸鈉溶液模擬工業制備兩步法合成次磷酸鈉晶體。
Ⅰ.制備次磷酸鈣[Ca(H2PO2)2]溶液: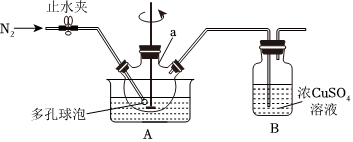
(1)實驗前,經檢驗裝置的氣密性良好。其中儀器a的名稱為。
(2)將一定量的白磷和過量的熟石灰依次投入儀器a中,加水調成稀漿狀,攪拌下加熱升溫到90℃,至無PH3氣體放出時停止反應。則a中發生反應的化學方程式為。
(3)實驗過程中裝置B中出現紅色沉淀,則硫酸銅溶液的作用是。
Ⅱ.制備次磷酸鈉(NaH2PO2)溶液: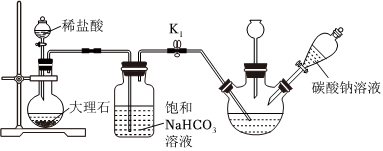
(4)過濾除去未反應的固體物質,然后通入二氧化碳,其目的是再向次磷酸鈣溶液中加入碳酸鈉溶液,判斷次磷酸鈣完全反應的方法為。
Ⅲ.制備次磷酸鈉晶體:
(5)過濾除去碳酸鈣后將濾液蒸發濃縮,該操作需在條件下進行,再經過冷卻結晶,制得次磷酸鈉晶體。
Ⅳ.測定次磷酸鈉純度:
(6)測量步驟:稱取8.8g樣品溶于水配成25mL溶液置于錐形瓶中,再加鹽酸25mL,準確加入c1mol/L碘標準溶液V1mL,蓋好瓶塞,放在暗處30min。打開瓶塞,用少量蒸餾水洗瓶頸及瓶塞后,以淀粉溶液作指示劑,用c2mol/L硫代硫酸鈉標準溶液進行滴定,消耗硫代硫酸鈉溶液的體積為V2mL(已知I2+2Na2S2O3=Na2S4O6+2NaI)。測得晶體中NaH2PO2的質量分數為(列出表達式)。組卷:10引用:1難度:0.6 -
 19.綠色能源的開發利用是未來能源發展的重要方向,也是實現“碳中和”目標的重要舉措。氫能是重要的綠色能源,利用甲烷來制取氫氣的總反應可表示為:CH4(g)+2H2O(g)═CO2(g)+4H2(g),該反應可通過如下過程來實現:
19.綠色能源的開發利用是未來能源發展的重要方向,也是實現“碳中和”目標的重要舉措。氫能是重要的綠色能源,利用甲烷來制取氫氣的總反應可表示為:CH4(g)+2H2O(g)═CO2(g)+4H2(g),該反應可通過如下過程來實現:
反應Ⅰ:CH4(g)+H2O(g)═3H2(g)+CO(g)ΔH1=+206.3kJ?mol-1
反應Ⅱ:CO(g)+H2O(g)═CO2(g)+H2(g)ΔH2=-41.2kJ?mol-1
(1)總反應的△H=kJ?mol-1。
(2)反應Ⅰ在恒壓條件下,不同進氣比[n(CH4):n(H2O)]和不同溫度時測得相應的CH4平衡轉化率見表。
①c點平衡混合物中H2的體積分數為平衡點 a b c d n(CH4):n(H2O) 0.5 0.5 1 1 CH4平衡轉化率/% 50 69 50 20 ,a、b兩點對應的反應速率vavb(填“<”、“=”或“>”),判斷的理由為。
②若d點的總壓強為aMPa,則d點的分壓平衡常數Kp為(用平衡分壓代替濃度計算,分壓=總壓×物質的量分數)。
(3)反應Ⅱ在工業上稱為一氧化碳的催化變換反應,研究表明該反應用Fe3O4作催化劑,反應歷程如下:
第一步:Fe3O4+4CO=3Fe+4CO2
第二步:3Fe+4H2O=Fe3O4+4H2
已知第一步為慢反應,則第一步反應的活化能比第二步反應(填“大”或“小”)。
由于CO還原性較強,若將Fe3O4還原成Fe,并以Fe的形式大量存在于反應體系中,會使催化劑失去活性,但在實際生產中一般不會發生催化劑失去活性的情況,請結合一氧化碳的催化變換反應歷程說明理由。
(4)用二氧化碳與氫氣催化加氫制乙醇,其反應原理為:2CO2(g)+6H2(g)=CH3CH2OH(g)+3H2O(g)ΔH<0。經實驗測定在不同投料比x1、x2、x3時CO2的平衡轉化率與溫度的關系如圖曲線所示x=:從平衡角度分析,隨溫度升高,不同投料比時CO2的平衡轉化率趨于相近的原因是[n(CO2)n(H2)]。組卷:19引用:2難度:0.6


