2019-2020學年福建省福州八中高二(上)期末化學試卷(選考)
發布:2024/4/20 14:35:0
一、選擇題(共17小題,每小題3分,滿分51分)
-
1.《本草衍義》中對精制砒霜過程有如下敘述:“取砒之法,將生砒就置火上,以器覆之,令砒煙上飛著覆器,遂凝結累然下垂如乳,尖長者為勝,平短者次之”,文中涉及的操作方法是( )
A.萃取 B.蒸餾 C.過濾 D.升華 組卷:4引用:2難度:0.5 -
2.下列物質的水溶液能導電,但屬于非電解質的是( )
A.CH3CH2COOH B.Cl2 C.NH4HCO3 D.SO2 組卷:342引用:130難度:0.7 -
3.H2O2分解反應過程能量變化如圖所示,以下相關敘述正確的是( )
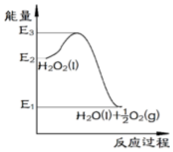
A.1molH2O2(l)鍵能總和比1molH2O(l)+0.5molO2鍵能總和大(E2-E1) B.該反應是吸熱過程 C.使用MnO2催化劑,E3將降低 D.2H2O2(l)=2H2O(l)+O2(g)△H=E1-E2 組卷:33引用:2難度:0.5 -
4.下列事實與鹽類水解無關的是( )
A.金屬焊接時可用NH4Cl溶液作除銹劑。 B.配制FeSO4溶液時,加入一定量Fe粉 C.長期施用銨態氮肥會使土壤酸化 D.使用泡沫滅火器滅火 組卷:56引用:3難度:0.8 -
5.已知室溫時,0.1mol/L某一元酸HA在水中有0.1%發生電離,下列敘述錯誤的是( )
A.該溶液的pH=4 B.由HA電離出的c(H+)約為水電離出的c(H+)的106倍 C.此酸的電離平衡常數約為1×10-7 D.升高溫度,溶液的pH增大 組卷:20引用:2難度:0.6 -
6.下列事實對應的離子方程式不正確的是( )
A.用碳酸鈉溶液處理鍋爐中的硫酸鈣水垢:CaSO4(s)+CO32-(aq)?CaCO3(s)+SO42-(aq) B.用加熱的方法降低自來水中鈣離子濃度:Ca2++2HCO3- CaCO3↓+H2O+CO2↑△C.用醋酸清洗熱水壺中的碳酸鈣水垢:2H++CaCO3═Ca2++H2O+CO2↑ D.用肥皂(主要成分C17H35COONa)檢驗含有較多鈣離子的硬水:2C17H35COO-+Ca2+═(C17H35COO)2Ca↓ 組卷:36引用:2難度:0.7 -
7.如圖所示裝置中,a、b都是惰性電極,通電一段時間后,b極附近溶液呈紅色,則下列說法正確的是( )
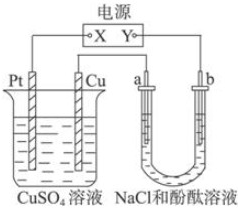
A.X是正極,Y是負極,CuSO4溶液的pH逐漸減小 B.X是正極,Y是負極,CuSO4溶液的pH保持不變 C.X是負極,Y是正極,CuSO4溶液的pH逐漸減小 D.X是負極,Y是正極,CuSO4溶液的pH保持不變 組卷:11引用:4難度:0.9 -
8.下列裝置或操作能達到目的的是( )
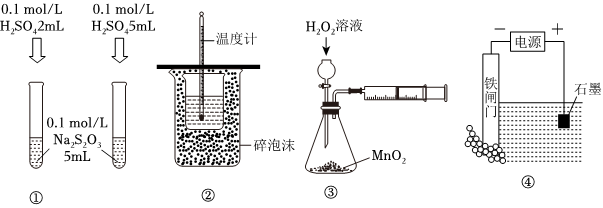
A.裝置①探究H2SO4濃度對反應速率的影響 B.裝置②可用于測定中和熱 C.裝置③測定O2的生成速率 D.裝置④保護鐵閘門不被腐蝕 組卷:18引用:7難度:0.6 -
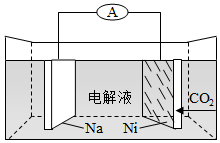 9.我國科學家研發了一種室溫下“可呼吸”的Na-CO2二次電池。將NaClO4溶于有機溶劑作為電解液,鈉和負載碳納米管的鎳網分別作為電極材料,電池的總反應為:3CO2+4Na?2Na2CO3+C.下列說法錯誤的是( )
9.我國科學家研發了一種室溫下“可呼吸”的Na-CO2二次電池。將NaClO4溶于有機溶劑作為電解液,鈉和負載碳納米管的鎳網分別作為電極材料,電池的總反應為:3CO2+4Na?2Na2CO3+C.下列說法錯誤的是( )A.放電時, 向負極移動ClO-4B.充電時釋放CO2,放電時吸收CO2 C.放電時,正極反應為:3CO2+4e-═2 +CCO2-3D.充電時,陽極反應為:Na++e-═Na 組卷:166引用:13難度:0.8
四、解答題(共2小題)
-
27.某鉻鹽廠凈化含Cr(Ⅵ)廢水并提取Cr2O3的一種工藝流程如圖所示。
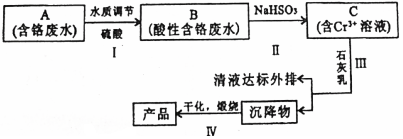
已知:Ksp[Cr(OH)3]=6.3×10-31Ksp[Fe(OH)3]=2.6×10-39Ksp[Fe(OH)2]=4.9×10-17
(1)步驟Ⅰ中,發生的反應為:2H++2?Cr2CrO2-4+H2O,B中含鉻元素的離子有O2-7。(填離子符號)
(2)產品中除Cr2O3外還含有的主要雜質是。
(3)若測得清液pH=5,此時Cr3+的濃度=mol/L。
(4)當清液中Cr3+的濃度≤1.5mg?L-1時,可認為已達鉻的排放標準,上述清液是否符合鉻的排放標準。(填“是”或“否”)
(5)步驟Ⅱ還可以用其他物質代替NaHSO3作還原劑。
①若用FeSO4?7H2O作還原劑,步驟Ⅲ中參加反應的陽離子一定有。(填離子符號).②若用鐵屑作還原劑,當鐵的投放量相同時,經計算,C溶液的pH與c(Cr2)的對應關系如表所示。O2-7
有人認為pH=6時,c(Cr2pH 3 4 5 6 c(Cr2 )/mol?L-1O2-77.02×10-21 7.02×10-7 1.25×10-3 2.12×10-34 )變小的原因是Cr2O2-7基本上都已轉化為Cr3+.這種說法正確不正確,為什么?O2-7
答:。
③用足量鐵屑作還原劑時,為使所得產品中含鐵元素雜質的含量盡可能低,需要控制的條件有。組卷:6引用:1難度:0.5 -
28.無色氣體N2O4是一種強氧化劑,為重要的火箭推進劑之一。N2O4與NO2轉換的熱化學方程式為:N2O4(g)?2NO2(g)△H=+24.4kJ/mol
(1)平衡常數K可用反應體系中氣體物質分壓表示,即K表達式中用平衡分壓代替平衡濃度,分壓=總壓×物質的量分數[例如:p(NO2)=p總?x(NO2)]。寫出上述反應平衡常數Kp表達式(用p總、各氣體物質的量分數x表示);影響Kp的因素是。
(2)上述反應中,正反應速率v正=k正?p(N2O4),逆反應速率v逆=k逆?p2(NO2),其中k正、k逆為速率常數,則Kp為(以k正、k逆表示)。若將一定量N2O4投入真空容器中恒溫恒壓分解(溫度298K、壓強100kPa),已知該條件下k正=4.8×l04s-1,當N2O4分解20%時,v正=kPa?s-1。
(3)真空密閉容器中放入一定量N2O4,維持總壓強po恒定,在溫度為T時,平衡時N2O4分解百分率為a。保持溫度不變,向密閉容器中充入等量N2O4,維持總壓強在2po條件下分解,則N2O4的平衡分解百分率a'=。組卷:21引用:1難度:0.3


