2022-2023學年黑龍江省哈爾濱市德強學校高二(上)期末化學試卷
發布:2024/11/9 2:30:2
一、單選題(本大題共15小題,每題3分,共45分)
-
1.化學與生產生活息息相關,下列說法不正確的是( )
A.泡沫滅火器噴出的主要物質是Al(OH)3和CO2 B.長期使用(NH4)2SO4作化肥會使土壤酸化 C.電解飽和食鹽水可以得到金屬鈉和氯氣 D.合成氨工業中,將NH3及時液化分離有利于提高反應物的利用率 組卷:17引用:3難度:0.7 -
2.下列事實中,不能用勒夏特列原理解釋的是( )
A.向雙氧水中加入少量二氧化錳快速生成氧氣 B.用濃氨水和氫氧化鈉固體快速制取氨氣 C.向新制氯水中加入適量硝酸銀固體,氯水顏色變淺 D.可口可樂打開瓶蓋后有大量氣泡冒出 組卷:67引用:4難度:0.6 -
3.已知下列反應的平衡常數:①S(s)+O2(g)?SO2(g)K1;②H2(g)+S(s)?H2S(g)K2;則反應H2(g)+SO2(g)?O2(g )+H2S(g)的平衡常數是( )
A.K1-K2 B.K1+K2 C. K2K1D. K1K2組卷:175引用:3難度:0.8 -
4.在容積不變的密閉容器中進行反應:2SO2(g)+O2(g)?2SO3(g)△H<0.下列各圖表示當其他條件不變時,改變某一條件對上述反應的影響,其中分析正確的是( )
A. 
圖表示溫度對平衡的影響,且甲溫度較高B. 
圖表示t0時刻恒容充入He(g)C. 
圖表示t0時刻增大O2的濃度對反應速率的影響D. 
圖中a點v正>v逆組卷:115引用:4難度:0.6 -
5.已知1molH2O2分解放出熱量98kJ,在含少量I-的溶液中,H2O2分解的機理如下:
①H2O2+I-→H2O+IO-慢
②H2O2+IO-→H2O+O2+I-快
下列有關該反應的說法正確的是( )A.當該反應放出98kJ的熱量時會生成0.5molO2 B.H2O2的分解速率主要是由反應②決定的 C.IO-是該反應的催化劑 D.催化劑的加入改變了該反應的反應熱 組卷:67引用:2難度:0.7 -
6.下列圖示與對應的敘述相符的是( )

A.圖1表示反應:mA(s)+nB(g)?pC(g)ΔH>0在一定溫度下B的平衡轉化率(B%)與壓強變化的關系如圖所示,則x點正反應速率大于逆反應速率 B.圖2是可逆反應:A(g)+B(s)?C(g)+D(?)ΔH>0的速率時間圖象,在t1時刻改變條件只能是加入催化劑 C.圖3表示對于化學反應mA(g)+nB(g)?pC(g)+qD(g),A的百分含量與溫度(T)的變化情況,則該反應的ΔH<0 D.圖4所示圖中的陰影部分面積的含義是該物質物質的量的變化量 組卷:62引用:7難度:0.6 -
 7.堿性鋅錳電池以氫氧化鉀溶液為電解質溶液,其結構示意圖如圖所示,電池總反應式為:Zn+2MnO2+2H2O═Zn(OH)2+2MnOOH。下列說法中不正確的是( )
7.堿性鋅錳電池以氫氧化鉀溶液為電解質溶液,其結構示意圖如圖所示,電池總反應式為:Zn+2MnO2+2H2O═Zn(OH)2+2MnOOH。下列說法中不正確的是( )A.電池工作時,電子轉移方向是由Zn經外電路流向MnO2 B.電池正極反應式為2MnO2+2H2O+2e-═2MnOOH+2OH- C.電池工作時,KOH不參與反應,沒有發揮作用 D.電池工作時,Zn發生氧化反應,MnO2發生還原反應 組卷:349引用:6難度:0.7
三、簡答題(本大題共3小題,共50分)
-
20.SO2是一種食品添加劑,還是重要的漂白劑和抗氧化劑,也是導致酸雨的主要物質。工業常用足量氨水吸收處理SO2尾氣。根據相關信息回答下列問題。
(1)下列操作能使氨水溶液中NH3?H2O的電離程度增大的是(填字母序號,下同),能使電離常數增大的是。
A.通少量氨氣
B.降低溫度
C.加水稀釋
D.升高溫度
E.加少量的NH4Cl固體
(2)常溫下,CH3COONH4的水溶液中由水電離出的c(H+)1.0×10-7mol?L-1(填“>“、“<“或“=”,下同),溶液中c(CH3COO-)c(NH4+)。[已知:常溫下Ka(CH3COOH)=Kb(NH3?H2O)]
(3)國家標準規定葡萄酒中SO2的最大含量為0.25g?L-1。某化學興趣小組向300.00mL葡萄酒中加入適量稀硫酸,加熱使SO2全部逸出,并用H2O2完全氧化生成H2SO4,用0.0900mol?L-1的NaOH標準溶液滴定所得H2SO4測定SO2的含量。
①滴定前,先在錐形瓶中滴入幾滴無色酚酞。達到滴定終點的標志是。
②讀數時,若滴定前平視液面,滴定后俯視液面,則對滴定結果的影響是(填“偏高”、偏低”或“無影響”)。
③滴定至終點后,計算出消耗NaOH標準溶液的體積。重復以上操作2次,具體數據見下表。
該葡萄酒中的SO2含量為滴定次數 1 2 3 V(NaOH)(消耗) 25.00mL 24.98mL 25.02mL g?L-1。組卷:12引用:2難度:0.7 -
21.2021年12月9日,神舟十三號航天員翟志剛、王亞平和葉光富在中國空間站太空授課,空間站內氧氣和二氧化碳的循環利用引發了同學們強烈的好奇心。請根據有關信息回答下列問題。
(1)空間站主要利用電解生活廢水及尿液實現氧氣再生,陽極的電極反應式為。
(2)葉光富介紹,有望在空間站利用CO2與H2反應生成水和燃料,實現呼吸產生的CO2與電解水產生的H2的高效循環利用。二氧化碳與氫氣制甲醇的總反應可表示為:CO2(g)+3H2(g)→CH3OH(g)+H2O(g)ΔH。
i.CO2(g)+H2(g)═CO(g)+H2O(g)ΔH1=+41kJ?mol-1
ii.CO(g)+2H2(g)═CH3OH(g)ΔH2=-90kJ?mol-1
①總反應的ΔH=kJ?mol-1;若反應i為慢反應,下列示意圖中能體現上述反應能量變化的是(填標號),判斷的理由是。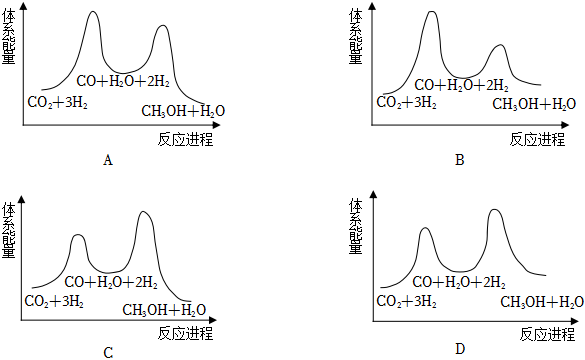
②甲醇是燃料電池的重要原料,若電解質為H2SO4溶液,則負極的電極反應式為。
(3)利用電化學原理可以將H2O和CO2轉化為O2和燃料(C3H8O),實驗裝置如圖所示,則H+移向極(填“a”或“b”)。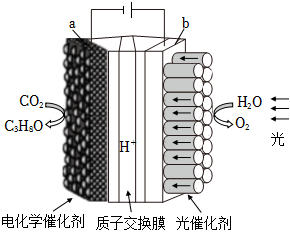 組卷:12引用:2難度:0.5
組卷:12引用:2難度:0.5


