2021-2022學(xué)年湖南省天壹名校聯(lián)盟高二(上)期中化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題:本題共10小題,每小題3分,共30分。在每小題列出的四個選項中,只有一項符合題目要求。
-
1.中華民族歷史悠久,有著優(yōu)秀的傳統(tǒng)文化。古詩詞的意蘊含蓄,意境深遠(yuǎn)。下列有關(guān)說法不正確的是( )
A.“落紅不是無情物,化作春泥更護花”中包含了復(fù)雜的化學(xué)變化過程 B.“零落成泥碾作塵,只有香如故”中的“香”體現(xiàn)了分子是在不斷運動的 C.“日照香爐生紫煙,遙看瀑布掛前川”中的“煙”是彌散在空氣中的PM2.5固體顆粒 D.“榆莢只能隨柳絮,等閑撩亂走空園”中的“柳絮”和棉花的成分均含有纖維素 組卷:7引用:1難度:0.8 -
2.設(shè)NA表示阿伏加德羅常數(shù)的值,下列敘述正確的是( )
A.在標(biāo)準(zhǔn)狀況下,11.2LCCl4分子中含氯原子數(shù)目為2NA B.34gH2O2中含有的陰離子數(shù)為1NA C.標(biāo)準(zhǔn)狀況下,2.24LNO與1.12LO2混合后的氣體分子數(shù)為0.1NA D.14g分子式為C2H4的鏈烴中含有的C-H鍵的數(shù)目為2NA 組卷:13引用:1難度:0.8 -
3.下列裝置或原理能達(dá)到實驗?zāi)康牡氖牵ā 。?/h2>
A. 
制取SO2B. 
凈化NO2C. 
分離乙醇與乙酸D. 
測氯水的pH組卷:4引用:1難度:0.5 -
4.下列有關(guān)物質(zhì)性質(zhì)與用途具有對應(yīng)關(guān)系的是( )
A.NH3具有還原性,可用作制冷劑 B.濃硫酸具有脫水性,可用于氣體的干燥 C.二氧化硫具有氧化性,可用于紙漿的漂白 D.FeCl3溶液能與Cu反應(yīng),可用作銅制線路板的蝕刻劑 組卷:9引用:1難度:0.8 -
5.下列微粒對一水合氨(NH3?H2O)的電離平衡幾乎不產(chǎn)生影響的是( )
A. 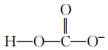
B. 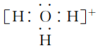
C. 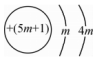
D.13R3+ 組卷:5引用:2難度:0.5 -
 6.X、Y、Z、W為原子序數(shù)依次遞增的4種短周期元素,其中Y、Z為金屬元素。X、Y、Z、W的最高價氧化物對應(yīng)的水化物甲、乙、丙、丁之間存在如圖所示反應(yīng)關(guān)系,圖中“—”相連的兩種物質(zhì)能發(fā)生反應(yīng)。下列判斷一定正確的是( )
6.X、Y、Z、W為原子序數(shù)依次遞增的4種短周期元素,其中Y、Z為金屬元素。X、Y、Z、W的最高價氧化物對應(yīng)的水化物甲、乙、丙、丁之間存在如圖所示反應(yīng)關(guān)系,圖中“—”相連的兩種物質(zhì)能發(fā)生反應(yīng)。下列判斷一定正確的是( )A.簡單離子半徑:Y>Z B.W位于元素周期表第三周期ⅦA族 C.X、Y、Z、W中,X的原子半徑最大 D.X的簡單氣態(tài)氫化物能使藍(lán)色石蕊試紙變紅 組卷:35引用:1難度:0.6
三、非選擇題:本題共4大題,共54分。
-
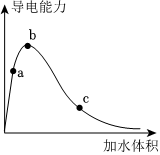 17.一定溫度下,將一定質(zhì)量的冰醋酸加水稀釋過程中,溶液的導(dǎo)電能力變化如圖所示。
17.一定溫度下,將一定質(zhì)量的冰醋酸加水稀釋過程中,溶液的導(dǎo)電能力變化如圖所示。
(1)a、b、c三點溶液的pH從大到小順序為。
(2)a、b、c三點溶液用1mol/LNaOH溶液中和,消耗NaOH溶液的體積大小關(guān)系為。
(3)用蒸餾水稀釋c點的醋酸,則下列各式表示的數(shù)值隨水量的增加而增大的是(填字母)。
A.c(CH3COO-)c(CH3COOH)
B.電離度α(CH3COOH)
C.c(CH3COO-)?c(H+)
D.c(CH3COOH)c(H+)
(4)已知CH3COOH的電離平衡常數(shù)Ka=1.8×10-5,0.5mol/LCH3COOH(aq)中c(H+)約為mol/L。
(5)體積為10mL,pH=2的醋酸溶液與10mL,pH=2的一元酸HX分別加水稀釋至1000mL,稀釋過程pH變化如圖,若將相同表面積的Mg分別加入等濃度的醋酸和HX溶液中,初始反應(yīng)速率為ν(CH3COOH)(填“<”“>”或“=”)ν(HX)。 組卷:8引用:1難度:0.6
組卷:8引用:1難度:0.6 -
18.氯氣是一種重要的化工原料。

(1)工業(yè)生產(chǎn)氯化物通常用由氧化物經(jīng)氯化作用生成的方法,例如工業(yè)上常采用“加碳氯化”的方法以高鈦渣(主要成分為TiO2)為原料生產(chǎn)TiCl4。
已知:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)△H1=+175.4kJ/mol;
2C(s)+O2(g)=2CO(g)△H2=-220.9kJ/mol。
沸騰爐中“加碳氯化”生成TiCl4(g)和CO(g)的熱化學(xué)方程式:。
(2)Cl2合成有機物時會產(chǎn)生副產(chǎn)物HCl。利用反應(yīng)4HCl+O22Cl2+2H2O可實現(xiàn)氯的循環(huán)利用。CuO/CuCl400℃
①該反應(yīng)的△S0(填“>”“<”或“=”)。
②若反應(yīng)物按物質(zhì)的量4:1(HCl:O2)在體積不變的密閉容器中發(fā)生該反應(yīng),下列敘述正確的是(填字母)。
A.當(dāng)不變時,說明反應(yīng)已達(dá)到平衡狀態(tài)c2(Cl2)?c2(H2O)c4(HCl)?c(O2)
B.當(dāng)ν(HCl)=2ν(Cl2)時,說明反應(yīng)已達(dá)到平衡狀態(tài)
C.平衡后,繼續(xù)按4:1的物質(zhì)的量之比投入HCl和O2,再次達(dá)到新平衡時,HCl的轉(zhuǎn)化率增大
D.平衡后,分離出H2O,可以提高Cl2的平衡產(chǎn)率,并加快正反應(yīng)速率
③如圖1是在兩個不同溫度T1和T2(T1>T2)下,改變時Cl2在平衡混合物中的體積分?jǐn)?shù)的變化規(guī)律曲線。下列敘述正確的是n(O2)n(HCl)(填字母)。
A.a點未達(dá)到平衡,c點一定已經(jīng)平衡
B.平衡常數(shù):Kb=Ka<Kd
C.達(dá)到平衡時O2的轉(zhuǎn)化率大小為a>b>c
D.若平衡常數(shù)K值變大,達(dá)新平衡前ν正始終減小
(3)在一定溫度下,以I2為催化劑,氯苯(C6H5-Cl)和Cl2在CS2中發(fā)生平行反應(yīng),分別生成鄰二氯苯(A)和對二氯苯(B),其反應(yīng)的化學(xué)方程式如下:
i.C6H5-Cl(aq)+Cl2(aq)?鄰二氯苯(A)(aq)+HCl(aq)
ii.C6H5-Cl(aq)+Cl2(aq)?鄰二氯苯(B)(aq)+HCl(aq)
向盛有3L含有I2的CS2(l)的容器中加入1.2molC6H5-Cl和1.2molCl2發(fā)生反應(yīng),忽略CS2溶液體積的變化,達(dá)到平衡時生成鄰二氯苯(A)和對二氯苯(B)的物質(zhì)的量(n)隨時間(t)變化的曲線如圖2所示。
①該溫度下,反應(yīng)ii的化學(xué)平衡常數(shù)Kii=。
②工業(yè)生產(chǎn)上,提高生成鄰二氯苯(A)反應(yīng)選擇性的關(guān)鍵因素是選擇合適的。組卷:11引用:1難度:0.7


